| Titel: | Versuche über Chlorometrie und neuer Chlorometer; von den HHrn. Henry Sohn, und A. Plisson. |
| Fundstelle: | Band 42, Jahrgang 1831, Nr. CII., S. 360 |
| Download: | XML |
CII.
Versuche uͤber Chlorometrie und neuer
Chlorometer; von den HHrn. Henry Sohn, und A. Plisson.
Aus dem Journal de Pharmacie. October 1831, S.
569.
Mit. Abbildungen auf Tab.
VI.
Henry und Plisson, Versuche uͤber Chlorometrie und neuer
Chlorometer
Unter Chlorometrie versteht man die Verfahrungsarten, wodurch man die Staͤrke
oder den Gehalt der Chloralkalien, d.h. die Menge des Chlors in demselben
ausmittelt. Wir lassen es uͤbrigens dahin gestellt, ob dieser Grundstoff
darin als solcher vorhanden, oder, was wahrscheinlicher ist, als chlorichte
Saͤure mit den Oxyden verbunden ist.Hr.
Soubeiran hat so eben der Akademie der
Wissenschaften eine Abhandlung uͤbergeben, worin er diese
Frage aufzuklaͤren sucht. Als. wir ihm unser chlorometrisches
Verfahren mittheilten, zeigte es sich, daß er auf dieselbe Idee gekommen
war, die Ausfuͤhrung derselben schien ihm aber etwas schwierig. A. d.
O.Das Princip, worauf sich der Chlorometer der HHrn. Henry und Plisson gruͤndet, ist
laͤngst bekannt und wurde auch schon seit vielen Jahren von einigen
Fabrikanten zur genauen Pruͤfung des Chlorkalks benuzt. Hr. Professor
Zenneck hat nach demselben ebenfalls den
Chlorgehalt einiger Chlorkalkmuster bestimmt (Erdmann's Journal fuͤr technische Chemie Bd. X. S. 293).
Wir theilen die Abhandlung der franzoͤsischen Chemiker unseren Lesern
bloß deßwegen mit, weil uns ihr Apparat zu diesen und aͤhnlichen
Versuchen sehr zwekmaͤßig zu seyn scheint. A. d. R.
Auch wollen wir nicht
alles dasjenige in Erinnerung bringen, was bisher in der Chlorometrie geleistet
wurde, um so mehr da dieses erst kuͤrzlich von Hrn. Marozeau (polyt. Journal Bd. XLI. S.
258) geschah; wir bemerken bloß, daß bei der ausgedehnten Anwendung,
welche von jenen Verbindungen heute zu Tage gemacht wird, dieser Gegenstand die
Aufmerksamkeit vieler ausgezeichneten Chemiker erregte, z.B. der HHrn. Welter, Gay-Lussac, Labillardière, Morin in
Genf, Marozeau u.s.w. Alle gaben sinnreiche und einfache
Verfahrungsarten an, um den Chlorgehalt der Chloruͤre zu bestimmen,
verschwiegen aber nicht, daß sie verschiedene Vorsichtmaßregeln erheischen, von
denen die Genauigkeit des Resultates abhaͤngt. Dahin gehoͤren die
Reinheit der Probefluͤssigkeit, die mehr oder weniger schnelle
Ausfuͤhrung des Versuches, die bisweilen wandelbare Beschaffenheit gewisser
Niederschlaͤge. Die Versuche, welche wir anstellten, um diesen
Uebelstaͤnden zu begegnen, fuͤhrten uns auf den unten beschriebenen
Chlorometer.
Dieser Apparat soll die Menge des Chlors durch ein gasfoͤrmiges Aequivalent
angeben und gruͤndet sich darauf, daß das Chlor, sowohl im freien Zustande,
als wenn es an Oxyde gebunden ist, mit Huͤlfe der Waͤrme gewisse
Ammoniaksalze oder fluͤssiges Ammoniak zersezt und eine
verhaͤltnißmaͤßige Menge Stikgas in Freiheit sezt, aus welchem man
sein Gewicht leicht berechnen kann. Es ist dieses dasselbe Princip, welches Hr. Soubeiran vor einigen Jahren zur Analyse der
ammoniakalischen Queksilbersalze benuzte.
Chlorometer nach dem Volumen.
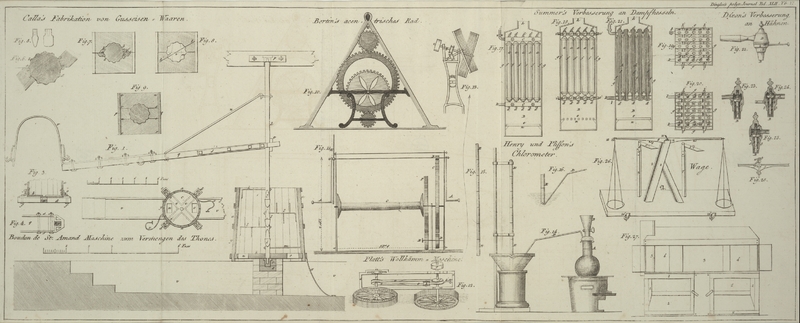
Der Apparat besteht aus einem glaͤsernen Ballon A
(Fig.
14), welcher ungefaͤhr 350 oder 400 Milliliter Wasser faßt; man
versieht ihn mit einem genau schließenden Stoͤpsel, durch welchen einerseits
ein glaͤserner, mit einem Hahn versehener, Trichter B und andererseits eine kleine gekruͤmmte Roͤhre D geht; leztere dient um die Gasarten aufzusammeln. Die
Muͤndung des Trichters und die Oeffnung der Gasroͤhre D muͤssen mit der Oberflaͤche des
Stoͤpsels im Innern des Apparates im Niveau 00 seyn und die Oeffnung des Hahnes (im Trichter)
muß weiter seyn als diejenige der Trichterroͤhre.
Man bedient sich zum Aufsammeln der gasfoͤrmigen Producte sehr enger Gloken,
welche aus glaͤsernen Barometerroͤhren E,
E (Fig.
15) von ungefaͤhr 3 Fuß Laͤnge und 4 bis 5 Linien
Durchmesser verfertigt und an einem Ende zugeschmolzen werden. Diese Gloken lassen
sich leicht an dem pneumatischen Apparat anbringen und muͤssen in Milliliter
graduirt werden. Die Grade sind so weit von einander entfernt, daß man leicht 1/2
und bisweilen 1/3 Milliliter ablesen kann. Man kann sich unseren Apparat selbst
verfertigen; zwei Gloken, wovon jede 13 bis 14 Centiliter faßt, sind
hinreichend.Man kann auch statt einer Gloke einen umgestuͤrzten Ballon anwenden,
dessen enger Hals in Milliliter graduirt ist und von dessen Kugel man die
Capacitaͤt genau kennt. A. d. O.
Ueber die Anwendung dieses Chlorometers.
Nachdem man den Ballon und die Roͤhre sorgfaͤltig verkittet hat,
bestimmt man genau die Capacitaͤt des Apparates, welche so lange
guͤltig ist, als man den Kitt des Ballons nicht wegnimmt, was in sehr langer
Zeit nicht noͤthig ist. Man bringt sodann eine Aufloͤsung von
Chloruͤr oder Chlorwasser, welche in bestimmten Verhaͤltnissen
bereitet sind, hinein.
Man nimmt z.B. 10 Gramme Chloruͤr und 0,25 Liter reines Wasser. Um aber eine
Fluͤssigkeit zu erhalten, welche das Ganze des zu untersuchenden
Chloruͤrs vollkommen repraͤsentirt, kann man 100 Grammen von diesem
sehr gut gemengten Chloruͤr abwiegen und sie mit 2 1/2 Liter Wasser sehr gut
und schnell in einem Porzellanmoͤrser abreiben; man bringt die Masse in eine
Flasche mit glaͤsernem Stoͤpsel und nachdem sie einige Augenblike sich
gesezt hat, gießt man 0,25 Liter davon ab.
Die Luft, welche beim Eintreten der Chloruͤraufloͤsung in den Ballon
ausgetrieben wird, faͤngt man nicht aufDamit mit den Fluͤssigkeiten keine Luft in den Ballon kommt, muß man
den Hahn erst dann oͤffnen, wenn der Trichter vorlaͤufig
angefuͤllt ist. A. d. O.. Man bringt sodann eine Gloke am Ende der gekruͤmmten Roͤhre
D an, wie man dieses in Fig. 16 besonders sieht.
Nachdem Alles so vorgerichtet ist, sezt man beilaͤufig einen Deciliter von
einer Aufloͤsung eines Ammoniaksalzes, z.B. schwefelsaurem,
anderthalb-kohlensaurem oder zweifachphosphorsaurem Ammoniak zu; lezteres
Salz oder auch bloß mit Wasser verduͤnntes Ammoniak ziehen wir vor. Die
Aufloͤsung des zweifach-phosphorsauren Ammoniaks bereitet man mit 10 bis 12 Grammen des
Salzes und 90 bis 100 Grammen reinen Wassers und die des reinen Ammoniaks mit
ungefaͤhr 0,01 Liter Aezammoniak von 22° Beaumé und 0,1 Liter
Wasser. Die Fluͤssigkeiten muͤssen moͤglichst luftleer
seyn.
Man erhizt allmaͤhlich und sammelt das Gas unter Wasser, in dem etwas Alkali
aufgeloͤst ist, um die Kohlensaͤure zu absorbiren, welche durch das
saure Salz entbunden werden koͤnnte; wenn Alles beendigt ist, fuͤllt
man den Apparat durch den Trichter ganz mit Wasser, um alles Gas auszutreiben.Durch die bloße Erkaltung fuͤllt er sich wegen der Statt findenden
Absorption von selbst. A. d. O. Das gasfoͤrmige Product besteht bloß aus der Luft des Apparates und
dem Stikstoff des zersezten Ammoniaks. Wenn man daher 1) die Capacitaͤt des
Gefaͤßes und 2) die Menge Luft, welche es nach dem Eingießen der
chlorhaltigen Fluͤssigkeit enthaͤlt, im Voraus kennt, so braucht man
nur von dem gasfoͤrmigen Product diese Quantitaͤt Luft abzuziehen, um
den Stikstoff zu erhalten, welcher dem gesuchten Chlor entspricht. Nachdem die
Correctionen wegen der Temperatur und Feuchtigkeit gemacht wurden, kennt man das
Volumen des troknen Stikgases, welches man bis auf 1/2 Millimeter genau messen kann;
man berechnet dann wie viel Chlor ihm entspricht, woraus sich der Gehalt oder Grad
des Chloruͤrs ergibt. Zum Beispiel: es sey 1) die Capacitaͤt des
Apparates gleich 0,400 Liter; 2) die chlorhaltige Fluͤssigkeit (von 10
Grammen Chloruͤr) gleich 0,250 Liter so werden in dem Apparat 0,150 Liter
Luft zuruͤkbleiben; 3) angenommen also der Versuch habe nach der Operation
und den Reductionen auf dasselbe Niveau u.s.w., das Volumen der troknen Gasarten bei
0°,076 gleich 0,325 Liter ergeben, so werden 0,175 Liter Stikgas entbunden
worden seyn, welche 0,525 Liter troknem Chlor entsprechen.
Die Reaction findet naͤmlich zwischen dem Ammoniak und dem Chlor Statt; 0,525
Liter Chlor nehmen 0,525 Liter Wasserstoff auf, welche 0,175 Liter Stikstoff
entweichen lassen. Die gebildete Salzsaͤure verbindet sich entweder mit dem
Ammoniak oder mit dem Kalk. Das Ammoniak und das Chlor
A²Z H⁶ + 3 C L²
geben als Producte:
A Z² + 3 C L² H²
Das Ammoniak und ein chlorichtsaures Salz
4 A Z² + H⁶ + 3 C L² x
erzeugen
4 A Z² + 3 C L² H² x.
Obiges Chloruͤr wuͤrde folglich in 1000 Grammen 52,5 Liter Chlor
enthalten. Vermittelst einer Tabelle kann man also aus dem Volumen des Stikstoffs
leicht den Gehalt eines Chloralkalis oder einer Chloraufloͤsung finden.
Tabelle.
Textabbildung Bd. 42, S. 364
Grade; Feuchter Stikstoff; Volumen;
Entsprechen troknem Stikstoff bei 0°; Volume troknes Chlor; Gehalt oder
Grad des Chloͤrurs; fuͤr 10 Gramme gepruͤftes
Chloruͤr
Vermittelst dieser Tabelle kann man durch eine einfache Berechnung den Gehalt eines
Chloruͤrs bei einer der angegebenen Temperaturen finden. Es entspreche z.B.
das erhaltene feuchte Stikgas 0,2 Liter bei einer Temperatur von 20° C., so
sezt man folgende Proportion an:
0,1 Liter : 27°,27 = 0,2 L. : x = 54°,54.
Versuche, welche die Genauigkeit dieses Verfahrens
beweisen.
Um uns von der Genauigkeit dieses chlorometrischen Verfahrens zu versichern, haben
wir nach demselben Fluͤssigkeiten gepruͤft, deren Gehalt wir genau
kannten. So vereinigten wir bekannte Quantitaͤten Chlor mit
Aufloͤsungen von Kali, Natron, Kalk und Bittererde entweder nach dem
Verfahren des Hrn. Gay-Lussac (Polytechn. Journal
Bd. XIV. S. 422Man darf dabei nur solche Salzsaͤure anwenden, welche frei von
schweflicher Saͤure ist. A. d. O.) oder indem wir ein bestimmtes Volumen reines feuchtes Chlor bei einer
bekannten Temperatur von den in Wasser aufgeloͤsten Oxyden absorbiren ließen.
Unsere Versuche entsprachen ganz unseren Erwartungen.
Das feuchte Chlorgas naͤmlich, womit wir die Versuche anstellten, entsprach
0,135 Liter troknen Chlors bei einer Temperatur von 0°,76 und mußte durch
seine Einwirkung auf Ammoniak oder Ammoniaksalze 0,045 Liter troknes Stikgas bei
0°,76 entwikeln. Bei unseren Versuchen erhielten wir:
1) Mit Chlorkalk (troknes Chlor 0,135
Liter)
Feuchter Stikstoff bei 20°1) 0,05
Liter2) 0,05 Liter, stark.
2) Mit Chlornatron (troknes Chlor 0,135
Liter)
Feuchter Stikstoff bei 20°1) 0,049
L.2) 0,051 L.
3) Mit Chlorkali (troknes Chlor 0,135
Liter)
Feuchter Stikstoff bei 20°1) 0,051
L.
4) Mit Chlorbittererde (troknes Chlor 0,135
Liter)
Feuchter Stikstoff bei 20°1) 0,05 L.
stark.
Dieß gibt nach den Reductionen im Mittel 0,0456 Liter troknes Stikgas.
Bemerkung.
Man thut gut, wenn man immer einen Ueberschuß von Aezammoniak oder Ammoniaksalz
mit dem Chloruͤr vermischt, um sicher zu seyn, daß sich alles Chlor
in Salzsaͤure umaͤndert und auch damit Anfangs nicht Spuren von
Chlorstikstoff entstehen koͤnnen.
Schluͤsse und Beobachtungen.
Aus diesen Resultaten ersieht man, daß man mit unserem Apparate eine große
Genauigkeit erreichen kann. Man koͤnnte einwenden, daß es groͤßere
Geschiklichkeit erfordert, als die bisher gebraͤuchlich gewesenen
Methoden. Diese Bemerkung hat auch in der That einiges Gewicht, allein heute zu
Tage findet man fast in allen Fabriken Personen, welche dazu hinreichende
chemische Kenntnisse besizen. Uebrigens erlangt man in kurzer Zeit die Uebung,
welche erforderlich ist, um sich desselben mit Genauigkeit bedienen zu
koͤnnen. In zweifelhaften Faͤllen, wo Chemiker zur Entscheidung
aufgefordert werden, duͤrfte dieses Verfahren unserer Meinung nach
weniger wandelbare Resultate geben, als alle anderen.
Fernere Anwendungen dieses Apparates.
Man kann mit diesem Apparate, wenn man Gloken anwendet, welche nach einem sehr
kleinen Maßstabe graduirt sind, mehrere Ammoniaksalze und ammoniakalische
Bittererdesalze vermittelst der Chloralkalien oder chlorichtsauren Salze
analysiren. Wir werden damit demnaͤchst einige Blasensteine
untersuchen.
Endlich kann man durch Vermischung der chlorichtsauren Salze mit Ammoniaksalzen
oder aͤzendem Ammoniak sich leicht und schnell Stikgas zu chemischen
Versuchen bereiten.
Tafeln