| Titel: | Ueber die Analyse des Schießpulvers; von Marchand. |
| Fundstelle: | Band 101, Jahrgang 1846, Nr. LXXVIII., S. 368 |
| Download: | XML |
LXXVIII.
Ueber die Analyse des
Schießpulvers; von Marchand.
Aus dem Journal für praktische
Chemie, 1846 Nr. 22.
Mit Abbildungen auf Tab. V.
(Beschluß der im polytechn.
Journal Bd. XCIII S. 288 enthaltenen Abhandlung.)
Marchand, über die Analyse des
Schießpulvers.
In dem ersten Theil dieser Abhandlung habe ich die Methoden
untersucht, welche von den verschiedenen Chemikern vorgeschlagen
worden sind, die Zusammensetzung des Schießpulvers zu ermitteln.
Ich habe gesucht, die Mängel der einzelnen Verfahrungsarten, wo
ich vergleichen wahrzunehmen glaubte, nachzuweisen, und will nun
die zweckmäßig erscheinenden Vorschriften praktisch prüfen und
daraus eine Vorschrift für die Analyse des Schießpulvers
zusammenstellen, welche den Anforderungen entspricht, mit
möglichst großer Genauigkeit, in kürzester Zeit und mit
geringster Schwierigkeit die Zusammensetzung des Pulvers zu
ermitteln.
I. Bestimmung des
Wassergehalts.
Aus den von mir angestellten Versuchen ergibt sich, daß die
Pulverkohle im Zustand der höchsten Feuchtigkeit, und bei
größter Vertheilung, im Vacuum über Schwefelsäure vollkommen
ausgetrocknet werden könne. (A. a. O. S. 296.)
Mit demselben Erfolg kann man sich eines vollkommen trocknen
Luftstroms bedienen, den man durch eine mit dem Schießpulver
angefüllte Röhre mehrere Stunden lang leitet. Dieses Verfahren
ist unbequem; einfacher ist es, den mit dem Pulver gefüllten
Tiegel in einen Trockenapparat zu bringen, wie er sonst schon
öfter angewendet ist, aus einer weithalsigen Flasche bestehend,
an deren Stöpsel man ein Gehänge angebracht hat, in welches das
Gefäß gesetzt wird. Der Boden der Flasche wird mit concentrirter
Schwefelsäure übergossen, welche man noch an den Wänden
derselben umherschwenkt. In einer solchen völlig trocknen
Atmosphäre trocknet das Pulver sehr schnell und
vollständig.Unter einer Glocke, welche eine mit Schwefelsäure
gefüllte Schale bedeckt, ist die Atmosphäre meist nicht
so trocken, daher die Exficcation nicht so
vollständig.
1) 5,612 Gramme SchießpulverZu diesem, wie zu allen folgenden Versuchen wurde eine
und dieselbe Pulversorte, in Halle käufliches
sogenanntes Berner Jagdpulver angewendet. verloren in der Trockenflasche nach 24
Stunden an Gewicht 0,063 Gramme. Nach drei Tagen war das Gewicht
nicht weiter unter 5,549 gesunken: dieß beträgt 1,13 Proc.
Feuchtigkeit.
2) 4,961 Gramme lufttrocknes Pulver verloren im Vacuum über
Schwefelsäure nach drei Tagen 0,055 Gramme Feuchtigkeit; darauf
sank das Gewicht nicht weiter; dieß beträgt 1,10 Proc.
Wasser.
In Ermangelung einer Luftpumpe kann man sich daher sehr gut der
Trockenflasche bedienen.
Am zweckmäßigsten verfährt man, wenn man das zu untersuchende
Pulver in eine eingeschliffene Stöpselflasche bringt und
dasselbe lufttrocken zu den Analysen benutzt. Die Zeit über,
welche zu der chemischen Untersuchung erfordert wird, läßt man
die zu trocknende Pulverprobe in der Flasche und berechnet
sodann die gewonnenen Resultate auf die trockne Masse.2 Gramme ausgeglühter Pulverkohle wurden mit Wasser
befeuchtet und in die Trockenflasche gebracht. Nach drei
Tagen hatte das Gewicht sich wieder auf 2,001 Gramme
vermindert.
II. Bestimmung des
Salpeters.
Um den Salpeter mit Schnelligkeit und Sicherheit zu bestimmen,
habe ich verschiedene Methoden angewendet. Zuerst suchte ich den
Kaligehalt des Pulvers dadurch zu erfahren, daß ich das Pulver
im Platintiegel mit einem Ueberschuß von Schwefelsäure
vermischte und bei einer Temperatur unter 160° R.
erhielt. Das salpetersaure Kali wird zersetzt, der Schwefel
entweicht zum Theil und nach einigen Stunden bleibt ein
Rückstand, den man scharf erhitzen kann, ohne daß er noch
detonirt. Dieser wurde in saures schwefelsaures Kali und dann
auf bekannte Weise in neutrales verwandelt. 100 Theile
schwefelsaures Kali entsprechen 116 Th. Salpeter.
Zuweilen explodirte die Masse noch, wenn schon alles
salpetersaure Salz zersetzt zu seyn schien, und wenn es mir auch
einigemal glückte, den Versuch ohne Unfall durchzuführen, so
kann ich diese Methode doch auf keine Weise empfehlen.
Nicht viel besser war das Resultat, als ich dem Pulver eine
acht- bis zehnfache Menge Salmiak zumischte, glühte und
den Rückstand in schwefelsaures Kali verwandelte. Die Verluste,
welche hiebei unvermeidlich eintreten, sind zu groß, um selbst
bei einer sehr sorgfältigen Ausführung ein gutes Resultat zu
gestatten.
Bei folgenden zwei Methoden bin ich stehen geblieben.
1) Auslaugen und
Eindampfen des Salpeters.
Diese Methode, dem Schießpulver durch Auswaschen zuerst den
Salpeter zu entziehen, ist die fast allgemein befolgte, und
es sind nur wenige Worte, welche ich hier anzuführen
habe.
Das unzerriebene Pulver, 5–6 Gramme, wird in einem
Becherglas mit heißem Wasser übergossen und häufig
umgerührt.
Nach einer Stunde filtrirt man die Lösung durch ein bei
80° R. oder in der Trockenflasche getrocknetes und
gewogenes, 5 Zoll im Durchmesser haltendes Filter. Der
Rückstand wird im Becherglase noch einigemal mit heißem
Wasser übergossen und zuletzt mit auf das Filter gebracht,
wo er vollständig ausgesüßt wird.
Während des Auswaschens wird die Lösung schon eingedampft,
und zwar am besten auf dem Wasserbad. Sind alle Waschwässer
vereinigt und eingedampft, so schmilzt man den Salpeter in
der Schale, während man diese, um Verlust durch Spritzen zu
verhüten, mit einer Glasplatte bedeckt hält. Die Schalen,
welche die Porzellanfabriken zu Meißen, Berlin,
Sèvres herstellen, sind leicht und hinreichend groß,
um hiezu angewendet werden zu können. Man wählt sie vom
Gewicht zu 60 Grammen; diese sind 3 1/2 Zoll breit und 3/4
Zoll tief und fassen etwa 60 Gramme Wasser; sie sind dann
nicht zu schwer für die gewöhnlichen feinen chemischen
Wagen.
Der auf dem Filter gesammelte Rückstand von Schwefel und
Kohle kann zur Controle in die Trockenflasche gebracht und
nach einigen Tagen gewogen werden. Nach 24 Stunden wird die
Wägung wiederholt und dadurch die Trockenheit der Substanz
nachgewiesen, wenn das Gewicht sich nicht geändert hat.
3) 4,906 Gramme trocknes Pulver gaben 3,879 Gramme Salpeter
– 79,06 Proc.
Der Rückstand von Kohle und Schwefel wog 1,032 Gramme = 21,03
Proc.
Der Ueberschuß von 1/10 Proc. ist ein zu übersehender
Beobachtungsfehler.
Die Extraction des Salpeters auf die angegebene Weise
erfordert immer eine ziemlich lange Zeit; man kann die
Operation sehr abkürzen, wenn man das Pulver in einen
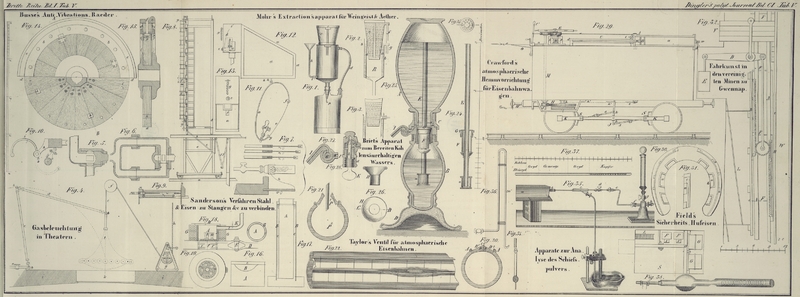
Deplacirungsapparat bringt. Eine Röhre von der Form Fig.
34, nämlich 7–8 Zoll lang und 5/4 Zoll
breit, ist unten in der Kugel mit ein wenig Asbest
verstopft; 5–6 Gramme Pulver werden darein geschüttet
und mit heißem Wasser übergossen. Durch einen gut
schließenden Kork bringt man auf die Röhre eine drei Fuß lange zweite Röhre, welche man mit Wasser anfüllt. Das
Auswaschen geht dadurch so schnell von statten, daß die
ganze Operation mit dem Eindampfen des Salpeters in drei
Stunden vollendet ist. Hat man den Asbest hinreichend dicht
eingelegt, so geht keine Kohle mit hindurch; liegt er zu
dicht, so fließt die Lösung zu langsam ab; man erneuet
sodann am besten den Apparat mit der Füllung. Nach einiger
Uebung schon trifft man das richtige Maaß.
Will man das Gewicht des Rückstands bestimmen, so legt man
die Röhre horizontal und verbreitet durch gelindes Klopfen
ihren Inhalt auf die eine Fläche der Röhre, so daß ein
Luftstrom hindurch geleitet werden kann, ohne etwas mit sich
fortzureißen. Ein trockner Luftstrom, durch einen Aspirator
erregt, welcher Tage lang hindurch geht, und zuletzt ein
längeres Verweilen im Vacuum über Schwefelsäure trocknet die
Masse vollständig aus.
4) 5,549 Gramme trocknes Pulver gaben auf diese Weise 4,400
Gramme Salpeter oder 79,29 Proc.
5) 4,053 Gramme lufttrocknes Pulver gaben 3,172 Gramme
Salpeter; von trocknem Pulver also (4,009) = 79,12 Proc.
6) 5,851 Gramme lufttrocknes Pulver gaben 4,576 Gramme
Salpeter, vom trocknen (5,787) = 79,07 Proc.
2) Bestimmung
des Stickstoffs im Schießpulver.
Die Bestimmung des Stickstoffgehalts im Pulver kann mit einer
so großen Schnelligkeit und Genauigkeit ausgeführt werden,
daß sie für die Personen, welche im Besitz des
erforderlichen Apparats sind, vor dem Aussüßen den Vorzug
verdienen kann.
Das Verfahren, den Stickstoff in den organischen Verbindungen
quantitativ zu bestimmen, ist von Erdmann und mir früher ausführlich beschrieben
worden.Journal für prakt. Chemie Bd. XIV S. 206 und Bd.
XXXVII S. 146. Mit Hülfe des von uns angewendeten Apparats, einer
gut evacuirenden Luftpumpe, einer hinreichenden Menge
kohlensauren Bleioxyds und Anwendung einer frisch
bereiteten, erst vorher gekochten (von Luft befreiten)
Kalilauge erhält man ganz genaue Resultate, die auf keine
andere Weise eben so schnell und bequem erreicht werden
können.
Eine kleine Abänderung an dem gewöhnlich benutzten Apparat
Fig.
35 macht ihn bedeutend bequemer. Man kann den Kork
b an der Verbrennungsröhre
mit einer 3–4 Zoll langen Glasröhre versehen und mittelst Kautschukverbindung diese an den
Messingapparat anbringen.
Auf diese Weise kann man die Verbrennungsröhre leicht
versiegeln und nachher aufklopfen. Ferner ist eine große
Unbequemlichkeit, den Quecksilberapparat auf die Erde zu
stellen, um das 30 Zoll lange Glasrohr anwenden zu können.
Diesem Uebelstand begegnet man durch die Anwendung einer
zuerst aufsteigenden und sodann 30 Zoll hinabsteigenden
Glasröhre Fig.
36. Beide Schenkel sind durch Korkstückchen mit
einander verbunden und erhalten auf diese Weise vollkommene
Festigkeit. Die Quecksilberwanne wird nun unmittelbar neben
den Verbrennungstisch gestellt. Am Glockenhalter wird ein
Arm angebracht, welcher das beim Auspumpen mit Quecksilber
gefüllte Rohr vor dem Umfallen schützt.
Beim Auspumpen steigt das Quecksilber in den hinabsteigenden
Schenkel auf; ein sehr heftiges Pumpen muß vermieden werden,
um das Quecksilber nicht in die Pumpe zu schleudern. Wenn
das Rohr lang genug gewählt ist, so tritt dieß niemals
ein.
Der Verbrennungsofen und das Kohlenfeuer kann zweckmäßig mit
der von Erdmann und mir
beschriebenen Verbrennungslampe vertauscht werden.
Um zu prüfen, eine wie große Sicherheit das Verfahren
darbietet in Beziehung auf die Salpeterbestimmung, so wurde
reiner Salpeter dieser Zerlegung unterworfen.
Es besteht derselbe
aus
KO
589,9
N
175,0
O
500,0.
Darnach enthalten 100 Theile 13,835 Theile Stickstoff.
Ein Gramm Luft nimmt bei 0° und 760 Mm. das Volumen
von 769,54 Kubikc. ein; das specifische Gewicht des
Stickstoffs ist 0,97137. Ein Gramm Stickstoff nimmt also das
Volum von 792,23 Kubikcentimeter ein; daher 0,13835 Gramme
das Volum von 109,60 Kubikcentimeter.
100 Kubikcentimeter Stickstoff bei 0° und 760
Millimeter entsprechen also 0,91216 Grammen Salpeter.
7) 1,376 Gramme Salpeter wurden mit der sechsfachen Menge
metallischen Kupfers gemengt und die Mischung in das
Verbrennungsrohr gebracht, dessen hinteres zugeschmolzenes
Ende mit kohlensaurem Bleioxyd, und dessen vorderes mit
metallischem Kupfer erfüllt wurden. Das Auspumpen wurde,
während die Kohlensäure sich reich entband, zwölfmal
wiederholt. Es wurden dabei erhalten 160 Kubikcentimeter trocknes Stickgas bei 10 1/2° R. und 752 Millimeter
B., auf 0° und 760 Mil. reducirt also 151
Kubikcentimeter.Das Gas zeigte nicht die geringste Reaction auf
Stickoxyd. Der Rechnung nach hätte man erhalten müssen 150,8
Kubikcentimeter.
Diese vollständige Genauigkeit zeigt hinreichend die
Anwendbarkeit der Methode.
Bei dem Schießpulver wurde die Bestimmung des Stickstoffs auf
eine ganz ähnliche Weise ausgeführt.
Das fein geriebene, vorher gewogene Pulver wurde mit dem
zwanzig- bis dreißigfachen Gewicht feinen Kupferoxyds
sehr innig gemengt und dieses
Gemenge in die Verbrennungsröhre gebracht. Die Länge
derselben beträgt 700 Millim.; davon sind 120 Millim. (circa 60 Linien) mit
kohlensaurem Bleioxyd angefüllt, darauf aber ungemengtes
Kupferoxyd, sodann die Mischung, ein wenig Kupferoxyd und
endlich gegen 300 Millim. metallisches Kupfer, am besten aus
Oxyd durch Reduction mittelst Wasserstoff gewonnen. (Siehe
Fig.
37.) Die Verbrennung dauert drei Viertelstunden.
Das Auspumpen vor Beginnen der Verbrennung wird zehn-
bis zwölfmal wiederholt.
8) 1,559 Gramme lufttrocknes Pulver gaben bei 11 1/2°
R. und 756 Millim. 142 Kubikcentimeter trocknes Stickgas,
entsprechend 1,225 Gr. Salpeter, oder von trocknem Pulver
79,3 Proc.
9) 1,868 Gramme desselben Pulvers bei 11 1/2° R. und
764 Mil. gaben 168 Kubikcentimeter trocknes Stickgas, oder
1,464 Gramme Salpeter, vom trocknen Pulver 79,2 Proc.
Die Uebereinstimmung ist so groß, als man sie nur irgend
wünschen kann, mit dieser und den Analysen 3, 4, 5, 6.
Es ist so eben angenommen worden, daß der Stickstoffgehalt
des Schießpulvers allein von dem darin enthaltenen Salpeter
herrühre: dieß ist nicht ganz richtig. Die Kohle enthält
eine gewisse Quantität davon gleichfalls. Die Menge
desselben ist sehr gering, aber sie ist wahrnehmbar. Bei
einer sorgfältigen und ausführlichen Untersuchung über die
Verkohlung des Holzes habe ich gefunden, daß der
Stickstoffgehalt dieser Substanz großentheils in der Kohle
zurückgehalten wird. Glüht man diese sehr scharf, so
entweicht Ammoniak; dieß tritt daher sehr reichlich am
Schluß einer sehr vollständigen Verkohlung ein.
Der Fehler, welcher hiedurch herbeigeführt wird, kann noch
nicht ein halbes Procent betragen, und somit liegt er
wahrscheinlich innerhalb der
Gränzen des Beobachtungsfehlers, der freilich durch ihn, im
Fall eines unglücklichen Zusammentreffens vergrößert werden
kann.
Ich habe ferner versucht, den Salpeterauszug durch
Platinchlorid mit einiger Schnelligkeit zu bestimmen;
indessen ist, auch wenn man die Gay-Lussac'sche Fällungsmethode mit der
Burette hier in einer möglichst alkoholischen Lösung
vornimmt, die Operation jedenfalls langwieriger als das
Eindampfen der Lösung, abgesehen davon, daß die
Zusammensetzung des Platinchloridkaliums nicht mit völliger
Sicherheit bekannt ist. Die Versuche, welche ich über die
Zusammensetzung dieses Salzes angestellt habe, gaben eine
merkliche Abweichung von den bisher angenommenen. Endlich
muß ich noch einmal auf die Methode zurückkommen, welche Becker vorgeschlagen hat.Journal für prakt. Chemie Bd. XXXII S. 52. Dieses Verfahren ist, auch wenn man sich der
genauesten Bestimmung des specifischen Gewichts der
Salpeterlösung bedient, dennoch nicht geeignet, die Menge
des Salpeters in der Flüssigkeit zu berechnen, da die Lösung
nicht in demselben Maaße, als ihr Salzgehalt zunimmt, auch
an Dichtigkeit gewinnt. Die Dichtigkeit nimmt vielmehr bei
größerer Sättigung verhältnißmäßig weniger zu.
III. Bestimmung des
Schwefels.
Die Gesammtmenge des Schwefels und der Kohle ergibt sich aus der
Salpeterbestimmung. Durch directe Wägung des ausgezogenen
Rückstandes wird die gefundene Zahl controlirt (An. 3). Die
Menge des Schwefels kann direct bestimmt werden, oder dadurch,
daß man die Menge der Kohle feststellt, der Verlust gibt sodann
die Quantität des Schwefels.
Am sichersten bei allen Analysen ist es, alle Substanzen direct
zu bestimmen, so daß die Verluste sich nicht auf einen einzigen
Bestandtheil werfen. Den Schwefel aus dem Verlust zu bestimmen,
ist nicht zweckmäßig, weil die Bestimmung der Kohle die meisten
Schwierigkeiten darbietet. Soll eine Substanz aus dem Verlust
gefunden werden, so geschieht dieß am besten mit der Kohle.
1) Bestimmung
des Schwefels als schwefelsaurer Baryt.
Dieses Verfahren ist von den meisten Chemikern angewendet
worden; den Schwefel in das Barytsalz umzuwandeln, hat man
sehr verschiedene Mittel. Der Umstand, daß 1 Theil
Ḃa noch nicht den siebenten Theil Schwefel enthält (100,000 Ḃ
= 13,717 S, 34,295 ) macht diese Gewichtsbestimmung
genauer als viele andere.
Die Oxydation des Schwefels durch ein Gemenge des Pulvers mit
kohlensaurem und salpetersaurem Baryt bietet am wenigsten
Schwierigkeiten dar, geht am schnellsten vor sich und gibt
die genauesten Resultate. Ich halte daher dieses Verfahren
für das zweckmäßigste. LöwigJournal für prakt. Chemie Bd. XVIII S.
128. hat vor mehreren Jahren ein Gemenge des
kohlensauren Baryts mit dem salpetersauren vorgeschrieben,
um dadurch, ganz nach Art der organischen Verbrennungen, den
Schwefel zu bestimmen. Man kann es mit Vortheil auf die
Analyse des Schießpulvers anwenden. Eine Mischung von 1
Theil Barytnitrat mit 3 Theilen Barytcarbonat wird zur
zwölffachen Menge mit dem Pulver innig gemischt und in eine
Glasröhre gebracht, welche an einem Ende zugeblasen ist.
Darauf wird eine Schicht des Salzgemenges ohne Pulver
geschüttet, etwa 3–4 Zoll lang, und die Röhre auf der
Verbrennungslampe, oder im Verbrennungsofen von vorn nach
hinten geglüht.
Das Gemenge schmilzt nicht und läßt sich leicht aus der Röhre
entfernen. Diese wird mit verdünnter Salzsäure ausgespült
und in derselben die geglühte Masse gelöst. Die Flüssigkeit
wird im Becherglas oder einer Porzellanschale im Wasserbad
mehrere Stunden nahe der Siedehitze gehalten und kann dann
sogleich filtrirt werden. Es tritt fast niemals ein, daß der
Niederschlag dann noch trübe durch das Filter ginge.
Das Auswaschen des Niederschlags wird mit siedendem Wasser
lange Zeit fortgesetzt.
10) 2,414 Gramme lufttrockenes Pulver gaben 1,710
Ḃa oder 0,23457 Gramme Schwefel = 9,71 Proc., vom
trocknen Pulver (2,388) 9,82 Proc. Schwefel. Die Quantität
des schwefelsauren Baryts fällt hier ein wenig zu hoch aus,
indem sich die sandigen Beimengungen mit diesem mischen. Sie
betragen aber 0,5 vom ganzen Pulver, s. Vers. 22.
Ganz ähnlich ist die Methode von Gay-Lussac; doch ist dieselbe, da die
Verbrennung in einem Tiegel vorgenommen wird, nicht ohne,
wenn auch unbedeutenden Verlust auszuführen.
Es wird das Pulver innig gemischt mit der gleichen Menge
Salpeter, kohlensaurem Natron und der vierfachen Menge
Kochsalz. Das Gemenge wird im Platintiegel weiß gebrannt,
die Lösung in Salzsäure läßt
eine kleine Menge Sand entdecken, welche bei dieser und den
folgenden Methoden abgeschieden werden kann.
11) 5 Gramme Pulver gaben auf diese Weise 3,432 Gramme
schwefelsauren Baryt, oder 0,47075 Gramme Schwefel = 9,41
Proc., von dem trocknen Pulver (4,945) = 9,52 Proc.
Schwefel.
Diese Quantität ist etwas geringer wie die bei Vers. 10 und
13 gefundene, da eine kleine Menge Schwefel unverbrannt
entweicht und schon durch den Geruch bemerkt werden kann.
Deutlicher läßt sich dieß nachweisen, aber zugleich
vermeiden, wenn man die Oxydation in einer Glasröhre
vornimmt, in welche man die Mischung einfüllt, und sie
darauf mit einem Theil des pulverfreien Salzgemenges
überschüttet. Bei der ersten Einwirkung der Hitze sublimirt
Schwefel, welcher über das Salzgemisch hinstreicht und hier
völlig verbrennt.
12) 5 Gramme, auf ganz dieselbe Weise behandelt, gaben 3,521
Gramme Ḃa oder 0,48295 Schwefel = 9,65 Proc.,
von dem trocknen Pulver (4,945 Gramme) = 9,76 Proc.
Schwefel.
Das angewendete Gemenge schmilzt in der Röhre; beim Erkalten
springt dieselbe leicht, daher das Gemenge des
kohlen- und salpetersauren Baryts den Vorzug vor
dieser Mischung zu verdienen scheint.
Außer dieser Bestimmung des Schwefels auf trocknem Wege läßt
sich dieselbe mit Sicherheit auf nassem Wege ermitteln. Im
Grund ist die von Ure angewendete
Methode die, welche am zweckmäßigsten angewendet wirdPolytechn. Journal Bd. XXXIX S. 269., nur daß man, wie Millon
dieß besonders empfohlen hat, anstatt der
Chlorwasserstoffsäure und des chlorsauren Kalis, eine
Mischung von Salpetersäure mit chlorsaurem Kali benutzt.
In einem Glaskolben werden 2–3 Gramme Pulver mit
concentrirter Salpetersäure übergossen und etwa 1–2
Decigramme chlorsaures Kali hinzugefügt. Die Masse wird in
schwachem Sieden erhalten; sobald der Geruch nach chloriger
Säure verschwunden ist, oder selbst früher, fügt man von
Neuem eine gleiche Menge des chlorsauren Salzes hinzu.
Sowohl Schwefel als Kohle oxydirt sich, und man erhält nach
längerer Einwirkung eine ganz farblose Flüssigkeit. Diese
wird mit vielem Wasser versetzt und zu der heißen Mischung
Chlorbaryum hinzugefügt. Läßt man den Niederschlag längere
Zeit nahe bei 80° R. stehen, so kann er bald ohne
Schwierigkeiten filtrirt werden. Auch hier muß das Aussüßen
sehr lange Zeit fortgesetzt werden.
13) 1,431 Gramme lufttrocknes Pulver gaben 1,003 Gramme schwefelsauren Baryt = 0,1,3759 Gramme Schwefel = 9,61
Proc., vom trocknen Pulver (1,416) = 9,72 Proc.
14) 5,000 Gramme trocknes Pulver gaben 3,572 Gramme
Ḃa und 0,0022 Gramme geschmolzenen Schwefel = 0,4921
oder 9,84 Proc. Schwefel.
Nimmt man die Reaction in einer Retorte vor und fängt die
abdestillirende Flüssigkeit in einer Vorlage auf, so findet
man kleine Mengen von Schwefelsäure darin. Bei einer Probe,
in der 5 Gramme Pulver auf diese Weise oxydirt wurden, ergab
das Destillat 0,006 Gramme schwefelsaure Baryterde; man
verfährt daher am sichersten, wenn man die Destillation in
einer tubulirten Retorte vornimmt, den Hals derselben unter
Wasser taucht und nach Beendigung der Reaction den Inhalt
der Retorte mit dem der Vorlage vermengt und die Spülwässer
hinzufügt, um in der ganzen Menge die Schwefelsäure zu
bestimmen.
Diese Methode, deren Genauigkeit nichts zu wünschen übrig
läßt, hat den einzigen Uebelstand, daß sie lange Zeit
erfordert, während welcher das Kochen der Säure fortgesetzt
werden muß. Außerdem sind die sich entwickelnden Dämpfe
beschwerlich.
Um dem langweiligen Filtriren und Auswaschen des
schwefelsauren Baryts zu entgehen, so hat Gay-Lussac vorgeschrieben,
die Menge der Schwefelsäure mittelst einer gradirten Lösung
zu bestimmen. (A. a. O. S. 55.) Nach den jetzt angenommenen
Aequivalentzahlen würden 152,63 Theile krystallisirtes
Chlorbaryum 20,00 Theilen Schwefel entsprechen. Wenn jedoch
diese Methode für die meisten Anforderungen hinreichend
genau ist, so hat sie doch einen kleinen Fehler, welcher
darin besteht, daß der niedergefallene schwefelsaure Baryt
immer eine kleine Menge Chlorbaryum mit einschließt, welche
selbst durch Auswaschen mit siedendem Wasser nicht entfernt
werden kann.
Da diese Quantität bei dieser Art zu fällen gar nicht
zerlegt, sondern unmittelbar niedergerissen, und doch als
zerlegt berechnet wird, so ist die aus dem verbrauchten
Chlorbaryum sich ergebende Schwefelmenge ein wenig zu
hoch.
IV. Trennung des
Schwefels von der Kohle.
Man kann, um das relative Verhältniß der Kohle und des Schwefels
zu bestimmen, die von Wöhler im
Journal für prakt. Chemie Bd. XXXII S. 58 beschriebene Methode
benutzen.
Am besten verfährt man, eine ungewogene Menge der Mischung des
Schwefels und der Kohle möglichst trocken (etwa einen Gramm) in
die Röhre Fig.
38 zu bringen, den Schwefel in das Kupfer zu treiben,
die durch einen trockenen Luftstrom vom Wasserstoff befreiten
Röhren zu wägen, nachdem man ihr Gewicht, mit Kupfer angefüllt,
ebenfalls genommen, die Kohle auszuschütten und wieder zu wägen.
Dadurch erhält man die relative Menge der Kohle zum
Schwefel.
Hiebei ist jedoch zu bemerken, daß die Kohle meist zu gering
gefunden wird. Die Hitze, welche man anwenden muß, um die Kohle
völlig vom Schwefel zu befreien, ist meist größer als die, bei
welcher sie dargestellt war, sie verkohlt sich daher unter nicht
unbedeutendem Gewichtsverlust noch vollkommner. Man bemerkt aus
diesem Grunde während des Abtreibens des Schwefels, wenn dieser
auch völlig vom glühenden Kupfer zurückgehalten wird, einen
starken Geruch nach Holzsäure; Kohlensäure und Kohlenoxyd
entweichen neben Wasser und andern Stoffen.
Ich habe Faulbaumholzkohle, welche 28 Proc. Ertrag bei der
Verkohlung gegeben hatte, in einer Wasserstoffatmosphäre,
nachdem ich sie völlig ausgetrocknet hatte, heftig geglüht und
dabei folgende Resultate gefunden:
15) 1,764 Gramme Kohle verloren 0,204 Gramme = 11,5 Proc. Eine
andere Menge derselben, gleichfalls sorgfältig getrockneten
Kohle wurde eine Stunde lang heftig geglüht:
16) 3,236 Gramme Kohle verloren 0,479 Gramme = 14,7 Proc. Weiter
konnte der Verlust nur durch eine außerordentlich anhaltende
Hitze und starkes Kohlenfeuer getrieben werden.
Diese Zersetzung der Kohle zu vermeiden, ist außerordentlich
schwer, namentlich da man leicht den entgegengesetzten Fehler
begehen kann, Schwefel bei der Kohle durch zu schwaches Glühen
zurückzuhalten.
17) Ueberschuß der Röhre nach langem, aber schwachem Glühen 1,459
Gramme.
Davon
Schwefel
0,666 Gramme
„ Kohle
0,793 „
S : C = 100 : 119.
Bei einem zweiten Versuch wurde die Kohle so heftig geglüht, als
die Hitze der Berzelius'schen Lampe
es gestattete.
18) Gewichtsüberschuß
nach dem Glühen
0,737 Gramme
Davon
Schwefel
0,3525
„
„
Kohle
0,3845
„
Verhältniß des S : C = 100 : 109.
Durch das Glühen ist die Kohle hier wesentlich zersetzt worden,
so daß man wohl einen Verlust von 1/10 der ganzen Menge annehmen
darf (Vers. 15, 16); dadurch würde das Verhältniß auf 100 : 120
etwa kommen.
Bei Anwendung dieser Methode wird es immer rathsam seyn, die
Kohle stark zu glühen, um gewiß allen Schwefel zu entfernen, und
sodann für die Kohle 1/10 der gefundenen Menge
hinzuzunehmen.
Man kann die Menge der Kohle auf die Weise bestimmen, daß man die
in der Deplacirungsröhre nach dem Ausziehen des Salpeters
zurückgebliebene Masse trocknet und die Kohle im
Wasserstoffstrom glüht. Dabei tritt jedoch derselbe Umstand ein,
daß die Kohle stärker zu erhitzen ist, als sie ohne weitere
Zersetzung verträgt, daher auch hier von der gefundenen Menge
1/10 etwa noch hinzugerechnet werden muß.
19) 5,780 trocknes Pulver (An. 6) gaben 0,560 Gramme stark
geglühte Kohle = 9,6 Proc.; rechnet man dieses Zehntel hinzu, so
ergeben sich 10,56 Proc., eine Zahl, die mit den übrigen
Versuchen stimmt.
Anstatt die Kohle durch Abdestilliren von dem Schwefel zu
befreien und sie dadurch einer wesentlichen Zersetzung zu
unterwerfen, hat man gesucht, den Schwefel durch
Auflösungsmittel fortzuschaffen. Ich habe angeführt, daß man
hiezu namentlich des schwefligsauren Natrons, Schwefelkaliums
und des Schwefelammoniums sich bedient hat; zu demselben Zweck
habe ich den Schwefelkohlenstoff angewendet.
Sind die Extractionsmittel Salze mit fixen Basen, so ist es nicht
unmöglich, daß ein Theil derselben von der Kohle hartnäckig
zurückgehalten werde, wodurch die Menge derselben natürlich zu
groß ausfallen muß. Hat man daher die Kohle so lange
ausgewaschen, daß sie nichts Auflösliches mehr abgibt, so
trocknet man sie, am besten im Vacuum bei 80° R., bei
welcher Temperatur auch das Filter getrocknet seyn mußte,
bestimmt ihr Gewicht und verbrennt einen Theil derselben. Sie
darf dann keinen Rückstand hinterlassen, der mehr als 5–6
Proc. betrüge. Vergl. An. 22. Der andere Theil wird in einer, an
einer Seite zugeschmolzenen Röhre erhitzt; es darf kein Schwefel
sublimiren.
Der Schwefelkohlenstoff kann leicht angewendet werden und erlaubt
eine genaue Bestimmung der Kohle, namentlich wenn man das in der
Extractionsröhre mit Wasser erschöpfte Pulver zunächst mit
absolutem Alkohol in der Röhre übergießt, daß das Wasser
verdrängt wird, darauf SchwefelkohlenstoffDen Schwefelkohlenstoff rectificirt man vor der Anwendung
über Bleioxyd. gießt, bis derselbe beim Verdampfen keinen Schwefel mehr
hinterläßt, und den Schwefelkohlenstoff durch Alkohol auswäscht.
Man thut noch besser, den Schwefelkohlenstoff gemischt mit
absolutem Alkohol anzuwenden und die
Extractionsröhre in einen Trichter zu stecken, welcher mit
warmem Wasser gefüllt ist. Die Röhre geht durch den Schnabel des
Trichters, mittelst eines Korks luftdicht eingesetzt. Ist die
Kohle ausgewaschen, so leitet man durch die Röhre mittelst des
Aspirators einen trockenen Luftstrom, während die Röhre selbst
sich im Luftbad bei 96° R. befindet. Dadurch wird die
Kohle bald vollkommen getrocknet und kann genau gewogen werden,
natürlich indem man die Röhre sorgfältig verschlossen hält.
20) 5,549 Gram, trockenes Pulver (An. 4) hinterließen auf diese
Weise 0,610 Gram. Kohle = 10,99 Proc. Kohle.
Ein kleiner Verlust muß auch bei diesem Verfahren eintreten,
nämlich durch das Auswaschen der Kohle, sowohl durch Wasser als
namentlich durch Alkohol.
Schon bei der Erschöpfung des Pulvers durch Wasser findet man die
Flüssigkeit nicht farblos abfließend. Sie ist schwach gelblich
gefärbt durch die Substanzen, welche die Kohle noch einschließt
und welche auch durch die Hitze zerstört werden. Diese Stoffe,
wenn sie nicht durch Wasser vollständig ausziehbar sind, werden
jetzt durch den Alkohol fortgeführt. Kocht man Alkohol mit
namentlich schwach gebrannter Kohle (28 Proc.), so trübt sich
die Flüssigkeit beim Erkalten, bei Zusatz von Wasser fallen
weiße Flocken nieder. Es werden also Stoffe abgeschieden, welche
zu der Zusammensetzung der Kohle gehörten; ihr Gewicht fällt
daher jedenfalls zu gering aus.
Die Versuche, anstatt des Schwefelkohlenstoffes die obenerwähnten
Lösungsmittel zu benutzen, haben mir nicht gute Resultate
gegeben. Als ich das schwefligsaure Natron länger als 3 Stunden
auf das Gemenge von Schwefel und Kohle in der Siedhitze hatte
einwirken lassen, so fand ich die Kohle noch nicht von Schwefel
erschöpft. Nicht anders war die Einwirkung des Schwefelkaliums.
Besser gelang es mit dem Schwefelammonium, welches außerdem als
nicht fixe Basis haltende Substanz den Vorzug verdienen möchte
eben so wie das schwefligsaure Ammoniak. Alle diese Mittel
müssen sehr lange Zeit einwirken und sind dennoch zuweilen nicht
erschöpfend; außerdem hat man die Besorgniß bei einigen, daß die
Kohle von den nicht flüchtigen Stoffen zurückhält.
Die Menge der Asche der Kohle zu bestimmen, gelingt nicht mehr,
da die löslichen Antheile derselben natürlich ausgezogen sind;
man kann aber durch Verbrennung der Kohle finden, ob das Pulver
eine gewisse Menge sandiger Beimischungen enthält. Nicht so
sicher findet man diese durch Schlämmen des Pulvers. Man kocht
dasselbe, damit die Körner zerstört werden, und schlämmt die
suspendirte Kohle von dem Rückstande, der schwerer
ist, ab, sammelt diesen auf einem Filter und untersucht ihn,
namentlich ob Beimengungen von Bronzetheilchen darin enthalten
sind. Durch Lösung in Salpetersäure findet sich das Kupfer
sogleich. Meist sind diese Rückstände nur Sand, welcher beim
Trocknen des Pulvers hineinfällt.
21) 100 Gram. Pulver auf diese Weise geschlämmt, gaben einen
Rückstand von 0,148 Gram. Sand, eine Zahl, die etwas zu gering
seyn muß.
Verbrennt man die Kohle nach dem Ausziehen des Salpeters und dem
Abdestilliren des Schwefels, so erhält man eine nicht
unbedeutende Menge Asche, welche die sandigen Beimischungen
einschließt und die Verunreinigungen des Schwefels enthält. Aus
der Menge der angewendeten Kohle kann man die des Pulvers
berechnen, wenn man diese nicht vorher bestimmt hat. Für die
Kohle kann man durchschnittlich 1 Proc. Asche nehmen, der Rest
würde auf Sand und Verunreinigungen des Schwefels kommen.
22) 2,3 Gram. Kohle (oder 21 Gram. Pulver) gaben einen Rückstand
von 0,120 Gram. Davon kommen auf die Kohle etwa 0,020 Gram.
Asche, auf Sand 0,030 Gram., so daß der Schwefel (1,94 Gram.)
0,07 Gram, fremde Beimischungen haben würde, also über 3 Proc.
Dieß ist jedenfalls zu viel und man muß den größten Theil für
Sand rechnen. Beim Schlämmen der Asche wurden auch 0,085 Gram.
Sand gefunden, so daß auf den Schwefel etwa 0,015 Gram.
Verunreinigungen kommen könnten.
Die angeführten Analysen mit einander verglichen, geben folgende
Resultate:
1.
2.
1) Wassergehalt des
Pulvers
1,13 Proc.
1,10 Proc.
2) Salpetergehalt des trockenen Pulvers:
3.
4.
5.
6.
8.
9.
79,06 Proc.
79,29
79,12
79,07
79,30
79,20.
3) Schwefelgehalt des Pulvers:
10.
11.
12.
13.
14.
9,82 Proc.
9,52
9,76
9,72
9,84.
4) Kohlengehalt des Pulvers:
19Corrigirtes Resultat, doch ungenau.
20.
10,56 Proc.
10,99.
5) Verhältniß des Schwefels zur Kohle:
17.
18.
100 : 119
100 : 120
6) Fremde Beimengungen, Asche u.s.w.:
22.
0,57 Proc.
Mittel aus allen Analysen:
Salpeter
79,16Diese Zusammensetzung stimmt nahe mit der des
französischen Jagdpulvers überein:Salpeter78Schwefel10Kohle12
Schwefel
9,72
Kohle
10,99 Kohle durch Verlust
11,12
––––––––
99,37
Verhältniß des Schwefels zur Kohle = 100 : 112. Aus dem Verlust
100 : 114.
Oder, wenn man die Asche mit berücksichtigt und der Kohle 1 Proc.
Asche zuschreibt, so erhält man (die Kohle aus dem Verlust):
Salpeter
79,16
Schwefel
9,72
Kohle
10,65
Verunreinigung
0,47
Unter allen Methoden scheinen mir den Vorzug zu verdienen wegen
Sicherheit und Schnelligkeit: die
Salpeterbestimmung mittelst des Deplacirungs-Apparats
oder mittelst der StickstoffbestimmungFürchtet man, daß man durch Wasser nicht die ganze im
Pulver enthaltene Salpetermenge auslaugen kann, so
hat man die Bestimmung des gasförmigen Stickstoffes
vorzuziehen., die Schwefelbestimmung durch das Glühen des Pulvers
mit dem Gemenge des kohlensauren und des salpetersauren
Baryts, oder durch Behandlung mit Salpetersäure und
chlorsaurem Kali. Die Kohle wird durch den Verlust
bestimmt. Zieht man die directe Bestimmung vor, so
wendet man den Schwefelkohlenstoff an, was jedoch langwierig und
weniger sicher ist.
Hat man auf diese Weise die Zusammensetzung des Pulvers erfahren,
so ist damit noch nicht genau der Pulversatz gegeben, wie man
ihn zur Bereitung des Pulvers anwendet. Hat man durch die
chemische Analyse die Zusammensetzung eines Glases gefunden, die
einer Metalllegirung, so ist damit noch nicht das Verhältniß
gegeben, welches angewendet werden muß, um jene Verbindungen
hervorzubringen. Eben so bei dem Pulver! Während des Mengens und
der weitern Verarbeitung verstäuben die einzelnen Bestandtheile.
Am meisten geht die Kohle verloren, am wenigsten der Salpeter.
In welchem Maaße dieß stattfindet, kann natürlich nur ein jeder
Pulverfabrikant bei seinen eigenen Apparaten durch Versuche
erfahren. Es genügt hier, darauf hingewiesen zu haben.
Noch haben wir zu beachten, wie die Beschaffenheit der zu dem
Pulver verwendeten Materialien war, und wie dieß aus dem
fertigen Pulver zu beurtheilen sey? Ob und welche fremde
Beimengungen das Pulver enthielt? Ob der Salpeter rein sey? ob
der Schwefel keine Verunreinigungen enthalte? Endlich, und diese
Frage ist besonders wichtig, welchen Verkohlungsgrad die
angewendete Pulverkohle besitze?
1) Salpeter und
dessen Beimengungen.
Die Reinheit des Salpeters wird in der ausgelaugten
Flüssigkeit auf die Weise geprüft, daß man diese bis zur
Trockne eindampft, wieder auflöst und filtrirt, um die aus
der Kohle abgeschiedenen Substanzen dadurch von der Lösung
zu trennen. Mit Salpetersäure angesäuert, prüft man die
Lösung durch salpetersaures Silberoxyd und salpetersaure
Baryterde auf Chlor und schwefelsaure Verbindungen. War
Chlor darin enthalten, und vermuthet man noch außerdem
chlorsaure Salze, so dampft man einen zweiten Auszug bis zur
Trockne ein, glüht ihn, bis die Salzmasse ruhig fließt, löst
ihn in Wasser, säuert ihn durch Salpetersäure an, wobei
salpetrige Säure entweicht, und fällt die Lösung durch
salpetersaures Silberoxyd.
Ist die Menge des Chlorsilbers größer als die beim ersten
Versuch gefundene, so enthielt das Pulver chlorsaure Salze
(chlorsaures Kali). Aus der Differenz findet man die Menge.
100 Th. Chlorsilber entsprechen 85,495 Th. chlorsaurem
Kali.
Um eine Beimengung von Knallquecksilber zu entdecken, kann
man nach Ure's Vorschrift
verfahren.Polytechn. Journal Bd. XXXIX S. 269. Das Pulver wird mit Wasser und etwas
Chlorwasserstoffsäure digerirt und die Flüssigkeit mit
Schwefelwasserstoff geprüft. Ein entstehender Niederschlag,
der durch etwa aufgelöste Bronzetheilchen erzeugt seyn könnte, muß auf die bekannte
Weise auf die Gegenwart des Quecksilbers geprüft werden.
2) Schwefel.
Die Untersuchung des Schwefels beschränkt sich auf die
Prüfung eines etwaigen Arsenikgehalts und auf die erdigen
Beimengungen; von den letzteren ist schon oben bei der
Aschenbestimmung der Kohle gesprochen worden. (An. 22.) Ist
der Arsenik in höchst geringer Spur vorhanden, so kann er
vernachlässigt werden; man reicht zu seiner Entdeckung
vollständig aus, wenn man das Gemenge von Kohle und Schwefel
in der Extractionsröhre Fig.
34 mit Ammoniak auszieht, die Flüssigkeit
eindampft, ein wenig Ammoniak und sodann Säure hinzusetzt.
Eine sehr geringe Menge Arsenik gibt sich durch den gelben
Niederschlag zu erkennen, den man ferner auf Arsenik nach
bekannten Methoden zu prüfen hat. Früher wurde von einigen
Fabrikanten Schwefelantimon dem Pulver zugesetzt, welche
Beimischung auch in einer bedeutenden Artillerie
vorschriftmäßig geschah; jetzt ist diese Vorschrift
aufgehoben; sollte man diesen Zusatz vermuthen, so wird man
ihn leicht durch Auskochen mit Königswasser und Prüfung auf
die bekannte Weise auffinden.
3) Kohle.
Die wichtigste hier anzustellende Untersuchung ist die über
die Zusammensetzung der Kohle. Diese ist verschieden
zusammengesetzt nach dem Grade der Verkohlung, und diesen
Grad zu erfahren, kann man die Zusammensetzung des
Verkohlungsproducts benutzen. In einer besondern
Untersuchung über die Zusammensetzung der Kohle nach ihren
verschiedenen Verkohlungsgraden werde ich zeigen, wie sehr
bedeutend die Differenzen in dieser Beziehung seyn können,
und wie man in der That aus der Zusammensetzung den
Verkohlungsgrad bestimmen kann.
Die Kohle darf für diese Bestimmung nicht von dem Schwefel
befreit werden, weil alle Auflösungsmittel desselben auch
aus der Kohle mehr oder weniger Stoffe ausziehen. Schon bei
dem Auslaugen des Salpeters werden einige Substanzen aus der
Kohle fortgeschafft, ein Uebelstand, der sich nicht
vermeiden läßt, aber nicht vergrößert werden darf. –
Das Gemenge von Schwefel und Kohle wird unter der Luftpumpe
über Schwefelsäure getrocknet, bis es nicht mehr innerhalb
24 Stunden an Gewicht abnimmt. Auf die von Erdmann und mirJournal für prakt. Chemie Bd. XXVII S. 129.
angegebene Weise wird die Verbrennung der Kohle (mit
Schwefel gemengt) vorgenommen. Das Gemenge wird aus dem
Tiegel in die Verbrennungsröhre durch einen möglichst weiten
Trichter geschüttet, und frisch ausgeglühtes Kupferoxyd,
welches über Schwefelsäure oder in einer verschlossenen
Röhre erkaltet ist, darauf geschüttet und mit dem
Draht-Korkzieher innig gemengt.
Zwischen den Chlorcalcium – und den Kaliapparat muß
ein Bleisuperoxydrohr, welches sorgfältig ausgetrocknet ist,
gelegt werden. War die Temperatur nicht zu hoch bei der
Verbrennung, so entweicht keine schweflige Säure. Jedenfalls
wird sie durch das Bleisuperoxyd zurückgehalten.
23) 1,658 Gram, des trockenen Gemenges von Kohle und Schwefel
gaben 2,7235 Gram. Kohlensäure und 0,1813 Wasser.
Auf die 20,84 Proc. Rückstand kommen 10,65 Th. Kohle; daher
auf 1,658 Gram. 0,8473. Davon gehen 0,0083 Gram, als Asche
der Kohle ab, es bleiben also 0,839 Gram. Kohle. Diese
enthielten nach der Analyse 0,74274 Gram. C. und 0,02014 Gram. H., also 88,52 Proc. C. und 2,40 Proc. H.
Die Bestimmung der Zusammensetzung der Kohle ist von ganz
besondere Wichtigkeit, und es ist daher wichtig, diese
Analyse mit ganz besonderer Genauigkeit auszuführen. Wenn
sie gleich noch aus den angeführten Gründen ein nicht ganz
scharfes Resultat geben kann, so
wird man sich doch durch das angegebene Verfahren so viel
als möglich der Wahrheit nähern.
––––––––––
Schließlich muß ich noch einer Abhandlung erwähnen von dem
königl. württembergischen Oberst-Lieutenant L. v. Breithaupt, welche im polytechn.
Journal Bd. XCIII S. 342 erschienen ist:
„Betrachtungen über die Kraft und die
chemische Natur des Schießpulvers.“
Wenn ich mich mit den Ansichten des Verfassers, welcher von
absolut elektro-chemischen Voraussetzungen auszugehen
meint und in dem Schießpulver eine durch elektrische und
chemische Affinität gebundene homogene Masse erblickt,
abgesehen von den fernern Schlüssen, im Allgemeinen nicht
wohl einverstanden erklären kann, so kann ich am
allerwenigsten die vorgeschriebene Methode, das
Mischungsverhältniß des Pulvers zu prüfen, für angemessen
erachten. Das Verfahren der chemischen Analyse, sagt der
Verf., ist für den Artilleristen nicht praktisch; er schlägt
daher die Bestimmung des specifischen Gewichts vor. Auf
welche Weise dieß genommen werden soll, ist nicht angegeben,
es ist nur gesagt, man solle
Knirschpulver (zerriebenes Pulver) benutzen. Wie stark man
dieses in das Gefäß einpressen soll, ist gleichfalls nicht
gesagt; dennoch berechnet der Verf. mit großer
Uebereinstimmung mit dem Versuch, der 1,167 gab, für
geknirschtes Musketenpulver 1,168, indem er die
Zusammensetzungen zu 77,25 Salpeter, 8,25 Schwefel, 14,50
Kohle annimmt und für den Salpeter das spec. Gewicht 1,9,
für den Schwefel 1,8 und für die Kohle 0,36 annimmt.Die Uebereinstimmung der Rechnung mit dem Versuch muß
auf einem Rechenfehler beruhen, denn nach Br.'s Zahlen würde sich das
berechnete spec. Gewicht = 1,66 ergeben. Das spec. Gewicht des Salpeters ist 2,0 bis 2,1Kopp setzt 2,0, Karsten fand 2,1., das des Schwefels ist 2,07. Das der gepulverten
Kohle findet man zu 0,36, kann es aber durch Zusammenpressen
natürlich höher hinauf bringen. – Wenn man nun auch
annähme, daß das Verfahren von v. Breithaupt möglicherweise das richtige spec.
Gewicht ergeben könnte, was durchaus nicht der Fall ist, so
läßt sich nicht wohl einsehen, mit Hülfe welcher Formel man
aus der einen bekannten Größe 1,167 die drei unbekannten x. 2,1; y. 2,0; z. 0,36
berechnen kann.
Wenn man die Zusammensetzung des Pulvers erfahren will, so
wird man die Analyse nicht entbehren können, und wenn diese
auch nicht für jeden Artilleristen praktisch seyn kann, so
wird eine jede Artillerie gebildete Oficiere besitzen,
welche im Stande seyn werden, diese einfache Untersuchung
mit Sicherheit auszuführen.
Tafeln