| Titel: | Bestimmung des Schwefels in den Producten der Eisen-Industrie, den Erzen und den Brennmaterialien; von A. Rollet zu Creuzot. |
| Autor: | A. Rollet zu Creuzot |
| Fundstelle: | Band 233, Jahrgang 1879, S. 124 |
| Download: | XML |
Bestimmung des Schwefels in den Producten der
Eisen-Industrie, den Erzen und den Brennmaterialien; von A. Rollet zu Creuzot.
Aus dem Französischen von Ingenieur J. Ott, Neunkircher Eisenwerk.
Mit Abbildungen auf Tafel 15.
Rollet's Bestimmung des Schwefels in Eisen, Erzen u.
dgl.
Die Bestimmung des Schwefels in den Producten, Erzen und Brennmaterialien der
Eisenindustrie ist nach den seither gebräuchlichen Methoden im Allgemeinen gut oder
doch wenigstens verhältniſsmäſsig sicher, wenn die zu untersuchenden Substanzen eine
ziemliche Menge Schwefel enthalten. Trotzdem werden bei der Bestimmung des Schwefels
in Kohlen und Kokes, die doch eine verhältniſsmäſsig bedeutende Menge desselben
enthalten, selten einigermassen vergleichbare Resultate erzielt. Es ist dies jedoch
noch viel schwieriger bei Materialien, die nur geringe Mengen oder Spuren davon
enthalten, wie Qualitätsroheisen, Walzeisen und Stahl. Es sind dazu die bisher
gebräuchlichen Methoden vollständig ungenügend; sie geben weder annähernd richtige,
noch unter sich vergleichbare Resultate. Bei der Wichtigkeit des Einfluſses, den der
Schwefel auf die Qualität des Roheisens und namentlich des Eisens und Stahles hat,
war es jedoch von besonderem Interesse, eine völlig sichere Bestimmungsmethode
desselben zu besitzen. Diese Sicherheit gibt nachstehend beschriebener Methode den
Hauptwerth; nebenbei bietet sie noch den Vortheil, daſs sie sehr schnell und leicht
ausführbar ist.
Die früher allgemein angewendete Methode der Bestimmung des
Schwefels in Roheisen, Eisen und Stahl durch Auflösung des Metalles in oxydirenden
Säuren und nachheriger Fällung der gebildeten Schwefelsäure durch eine Barytsalz gab
sehr unsichere Resultate. Zunächst war man in Ungewiſsheit über die vollständige
Oxydation des Schwefels, dann über die Herkunft der gebildeten Schwefelsäure, ob
alle verwendeten Reagentien frei von derselben waren, und schlieſslich noch über die
Reinheit des Niederschlages.
Es wurde daher dieses Verfahren meistens ersetzt durch ein
anderes, welches auf der falschen Voraussetzung beruhte, daſs durch Auflösung des
Metalles in nicht oxydirenden Säuren aller Schwefel in
Schwefelwasserstoff übergeführt werde. So gründeten mehrere Chemiker, von der
Richtigkeit dieser Ansicht überzeugt, darauf ihre Bestimmungsmethode. Rivot empfahl, das Metall in Chlorwasserstoffsäure
aufzulösen und das entwickelte Gas in eine ammoniakalische Lösung von Kupferchlorür
zu leiten. Das gefällte Schwefelkupfer wurde dann entweder direct gewogen und der
Schwefel daraus berechnet, oder aber in Königswasser aufgelöst und dann die
Schwefelsäure als schwefelsaurer Baryt niedergeschlagen. Eggertz empfahl eine Vergleichung der Gröſse der auf kleinen Silberplatten
hervorgebrachten Flecken, welche durch das bei Auflösung von 0g,1 Metall in 2cc verdünnte Schwefelsäure entwickelte Gas entständen. Kürzlich noch
empfahl Boussingault (*1876 222 447), das Metall durch verdünnte Schwefelsäure aufzulösen und das
entwickelte Gas durch eine verdünnte Lösung von schwach angesäuertem Silbernitrat
streichen zu lassen. Der erhaltene Niederschlag von Schwefelsilber wurde geglüht und
der Schwefel aus dem Gewicht des erhaltenen Silbers berechnet.
Diese beiden ziemlich allgemein benutzten Methoden gaben für dieselbe Probe annähernd
übereinstimmende, jedoch ungenaue Resultate. In der That wechselt bei der einen wie
bei der anderen Methode die Menge des als Schwefelwasserstoff entwichenen Schwefels
nach dem Gehalt an übrigen Bestandtheilen der der Analyse unterworfenen Probe. Von
allen diesen Bestandtheilen scheint der Kohlenstoff den gröſsten Einfluſs auf die
Entwicklung des Schwefelwasserstoffes zu haben. Je mehr Kohlenstoff der zu
untersuchende Körper enthält, desto weniger Schwefelwasserstoff wird gebildet. Zudem
ist das nach der Methode Boussingault's
niedergeschlagene Silber nicht ausschlieſslich durch Schwefelwasserstoff gefällt,
sondern sehr häufig wird die gröſste Menge niedergeschlagen durch die in dem
reducirenden Gasstrome enthaltenen Wasserstoffverbindungen. Der dabei nicht als
Schwefelwasserstoff entwickelte Schwefel scheint in Verbindung von Wasserstoff und
Kohlenstoff' zu entweichen.
Von der Richtigkeit des so eben Angeführten kann man sich praktisch leicht überzeugen
und die wechselnde Menge des Schwefels, welche bei der Auflösung von Kohlenstoff
haltigem Eisen in nicht oxydirenden Säuren als Schwefelwasserstoff entweicht,
feststellen. Es genügt hierzu, den Schwefel in dem Roheisen und dem daraus
hergestellten Bessemerstahl im Augenblick seiner gröſsten Entkohlung, d.h. vor
Zusatz Mangan haltigen Roheisens, zu bestimmen. Es kommt alsdann sowohl bei der
Methode von Eggertz, wie bei der von Boussingault vor, daſs der Schwefelgehalt der
Stahlprobe das 3- bis 4 fache beträgt von dem des Roheisens, was doch, da aller
Schwefel ausschlieſslich von Roheisen herrührt, unmöglich ist. Die Ueberführung des
in dem unreinen
Schwefelsilber enthaltenen Schwefels in Barytsulfat beeinfluſst auch nichts
wesentlich in dieser Beziehung.
Leitet man hingegen die durch die Einwirkung von verdünnter Schwefelsäure oder
Chlorwasserstoffsäure auf Roheisen und Stahl erzeugten Gase durch eine rothglühende
Porzellanröhre, so findet eine Zersetzung der Wasserstoff-, Kohlenstoff- und
Schwefelverbindungen statt, nach welcher die ganze Menge des Schwefels als
Schwefelwasserstoff entweicht, dessen Schwefel alsdann durch eine Auflösung von
Silbernitrat zurückgehalten werden kann. Hierbei ist es jedoch nothwendig, zu dem
durch die Reaction der Säure auf das Metall gebildeten Wasserstoff einen weiteren
Wasserstoffstrom zuzuleiten, einestheils um alle Schwefelverbindungen aus der
Porzellanröhre zu entfernen, anderntheils um einen groſsen Ueberschuſs von
Wasserstoff im Verhältniſs zum Schwefel zu haben. Verfährt man auf diese Weise, so
wird man finden, daſs die jetzt gefundene Menge Schwefel, bezieh. niedergeschlagenes
Silber, bedeutend gröſser ist, als die gefunden und niedergeschlagen wurde durch
dieselben Gase, welche der höheren Temperatur nicht ausgesetzt waren. Ebenso ergibt
sich, daſs der Gehalt des Schwefels im Roheisen gröſser ist als in dem aus demselben
erzeugten Stahl – eine Thatsache, die allem bisher Bekannten entspricht, da die
Menge des durch die Schlacke abgeführten Schwefels bedeutend gröſser als umgekehrt,
das Ausbringen beim Proceſs sich durch den Abbrand vermindert, wie auch weiter noch
Schwefel durch die Verbrennungsgase abgeführt wird.
Die genaue Bestimmung des Schwefels in den Erzen und als solche behandelten Schlacken
bietet weniger Interesse, da hier nicht dieselbe Genauigkeit verlangt wird wie bei
Roheisen, Eisen und Stahl. Die bis jetzt gebräuchlichen Methoden geben hier
allerdings genügende Resultate, da die dabei unterlaufenden Fehler doch nicht von
groſsem Einfluss sind, vorausgesetzt natürlich, daſs sie eine gewisse Grenze nicht
überschreiten. Der Hauptschwefelgehalt der Hohofenbeschickung rührt, wenn nicht
besonders schwefelhaltige Erze verwendet werden, ja doch von Koke her. Immerhin
jedoch bietet nachfolgende Methode auch hier manchen Vortheil, da sie bei gröſserer
Genauigkeit doch einfacher und schneller durchzuführen ist. Wir wenden sie sowohl
zur Bestimmung des Schwefels in der Hohofenschlacke, wie bei den Kohlen und Kokes
an, wie sie ebenso zur Bestimmung des Schwefels in den Gasen benutzt werden kann.
Ueberhaupt läſst sie sich nach einigen Abänderungen auf alle Producte anwenden.
Beschreibung der Methode. Die seit fast 2 Jahren auf den
Werken des Creuzot eingeführte Methode beruht darauf, daſs der Schwefel der zu
untersuchenden Substanz zuerst in Schwefelwasserstoff verwandelt und dann als
Schwefelsilber niedergeschlagen wird. Aus dem Gewicht des letzteren wird der Schwefel
berechnet. Es ist dabei der Vortheil gewährt, einen verhältniſsmäſsig schweren
Niederschlag zu haben, wie auch dieser Niederschlag selbst sehr leicht zu
controliren ist. Die Ueberführung des Schwefels in Schwefelwasserstoff geschieht
durch Erhitzen der Substanz in einer Porzellanröhre bis zur oxydirenden Rothglut,
während gleichzeitig ein Gasgemisch von ¾ Wasserstoff und ¼ Kohlensäure
durchgeleitet wird.
Vor Uebergang zur Beschreibung der Methode, wie solche für jeden einzelnen Fall
anzuwenden ist, wird es vielleicht nicht ohne Interesse sein, die Wirkung anzugeben,
welche nach gemachten Versuchen reines trockenes Wasserstoffgas allein in der
Rothglut auf die Entschwefelung einzelner Substanzen, welche in der Eisenindustrie
Verwendung finden, hat, wie auch zu zeigen, zu welchem Zwecke Kohlensäure mit dem
Wasserstoffgas gemischt werden soll.
Entschwefelung durch reines trockenes
Wasserstoffgas. Auf Walzeisen: Vollständige Entschwefelung in sehr kurzer
Zeit.
Auf weiſses Roheisen und Stahl:
Langsame Entschwefelung, welche der Entfernung des Kohlenstoffes folgt und später
eine vollständige wird.
Auf graues Roheisen: Zuerst sehr
langsame Entschwefelung, welche später stärker wird in dem Masse, als der Graphit in
gebundenen Kohlenstoff übergeführt und dieser dann langsam vom Wasserstoff
weggeführt wird.
Auf Erze, Schlacken, Kalksteine u.
dgl.: Theilweise Entschwefelung, welche um so früher aufhört, je mehr die
zu untersuchende Substanz Metalle enthält, deren Oxyde oder Schwefelverbindungen
durch Wasserstoff allein nicht zersetzt werden, wie Calcium, Magnesium, Thonerde und
die Alkalien.
Alle diese Uebelstände bezieh. das unvollständige Zersetzen der Schwefelverbindungen
vermeidet man, wenn man das Wasserstoffgas mit ¼ seines Volumes gasförmiger
Kohlensäure vermischt. Der Schwefel sämmtlicher Materialien wird alsdann in sehr
kurzer Zeit in Schwefelwasserstoff übergeführt, ohne daſs eine Zersetzung oder
Oxydation des letzteren zu befürchten wäre. Der Kohlenstoff wird dabei entweder
meist vollständig verbrannt, wie bei Kohlen und Kokes, oder nur in den letzten
Spuren zurückgehalten, wie bei Eisen und Stahl. Ist der Kohlenstoff einmal entfernt,
so verschwindet der Schwefel leicht.
Bei den Erzen, Schlacken u. dgl. ersetzt der durch die Kohlensäure oder den
Wasserdampf zugeführte Sauerstoff den Schwefel der Metalle, deren Schwefel
Verbindungen durch Wasserstoff allein unzersetzbar sind. Es wird dadurch aller
Schwefel an den Wasserstoff abgegeben. Die Anwesenheit von Phosphor und Arsenik,
selbst in groſsen Mengen, ist ohne jeden Einfluſs auf die Genauigkeit des
Resultates.
Soll diese Bestimmungsmethode auf eine sehr schwefelhaltige Substanz angewendet
werden, z.B. ein Schwefelmetall, was jedoch in der Eisenindustrie selten nothwendig
werden wird, so darf nur eine sehr kleine Menge derselben zur Analyse genommen und
die Temperatur nur langsam erhöht werden. Ebenso ist es erforderlich, den
Wasserstoff in groſsem Ueberschuſs zuzuführen, während zur Verlangsamung der Zersetzung des Schwefels die
Menge der zuzuführenden Kohlensäure vermindert wird. Beobachtet man diese
Vorsichtsmaisregel nicht, so findet eine theilweise Zersetzung des gebildeten
Schwefelwasserstoffes statt und freier Schwefel setzt sich in den kälteren Theilen
der Röhre ab.
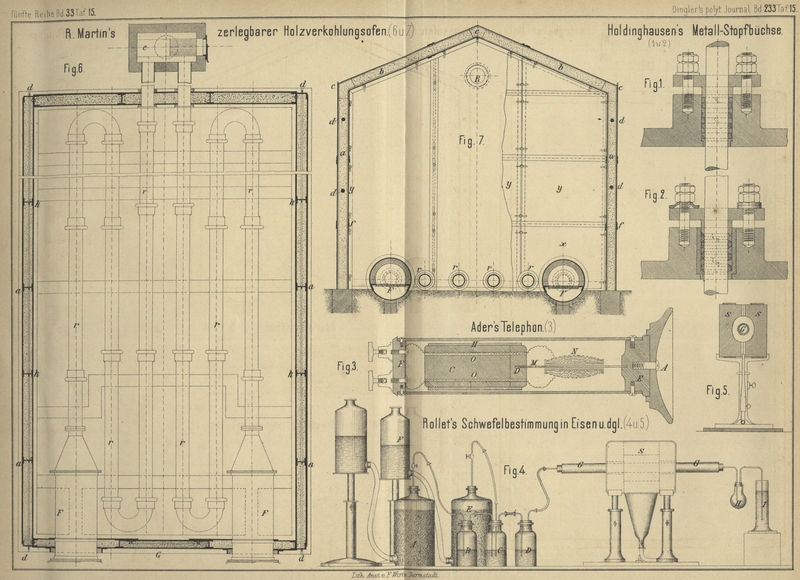
Der verwendete Apparat ist folgendermaſsen zusammengesetzt: Der in einem
Entwicklungsgfäſse A (Fig. 4 und
5 Taf. 15) durch reines Zink und verdünnte Schwefelsäure entwickelte
Wasserstoff streicht durch 3 Waschflaschen. Die erste B
derselben enthält eine Auflösung von essigsaurem Bleioxyd, die zweite C eine Auflösung von Silbernitrat, jedoch so verdünnt,
daſs ein Niederschlagen des überschüssigen Silbers als metallisches Silber vermieden
wird; die dritte Flasche D enthält reines Wasser, um
die aus der zweiten Flasche mitgerissenen Substanzen zurückzuhalten. Die zu
verwendende Kohlensäure, welche, nebenbei bemerkt, dem Wasserdampf wegen ihrer
praktischeren Anwendung, und weil sie reineres Schwefelsilber gibt, vorzuziehen ist,
wird dargestellt aus kohlensaurem Kalk (Flasche E) und
sehr verdünnter Salzsäure (Flasche F), die jedoch
möglichst frei von Schwefel sein muſs. Sie wird im richtigen Verhältniſs in der
zweiten Waschflasche C mit dem Wasserstoff gemischt.
Das Gasgemisch wird nun durch Glasröhren, welche mit nicht vulcanisirten
Kautschukschläuchen verbunden sind, in eine Porzellanröhre G von 25mm lichter Weite, in deren
Innerem sich die zu untersuchende Substanz befindet, geleitet. Die Porzellanröhre
ist mit zwei einfach durchbohrten Korkpfropfen verschlossen und verkittet. Der Ofen
besteht aus zwei ausgehauenen und mit Kupferblech belegten feuerfesten Steinen S, welche von zwei verschiebbaren kupfernen Stativen
getragen werden, um die Höhe des Ganzen reguliren zu können. Das Erhitzen geschieht
durch ein Fächergebläse mit Leuchtgas.
Die Verbrennungsgase streichen zuerst durch einen kleinen Ballon H, wo sich der gröſste Theil des Wasserdampfes absetzt,
der sich während der Operation gebildet hat, gehen von dort durch eine Lösung von
Silbernitrat in dem Cylinder I, wo sich der in der zu
untersuchenden Substanz vorhanden gewesene Schwefel als Schwefelsilber
niederschlägt. Die Silberlösung, welche sehr häufig gebraucht werden kann, wird
dargestellt durch Auflösung von 16 bis 18g
Silbernitrat in 1l Wasser und nachheriger
Neutralisation mit Ammoniak; derselben wird dann noch wieder 1 bis 2 Proc.
Salpetersäure zugesetzt, um sie schwach sauer zu machen.
Bestimmung des Schwefels in Roheisen, Eisen und Stahl
Von der fein zerkleinerten Substanz, welche durch ein Seidensieb von 900 Maschen auf
1qc gegangen sein muſs, nimmt man 2 höchstens
4g, gibt sie in ein Porzellan- oder
Platinschiffchen von 10cm Länge und 15mm Breite. Bei Eisen muſs wegen der darin
sitzenden Schlacke darauf gesehen werden, daſs alle zur Zerkleinerung angewendete Substanz durch das Sieb
gegangen ist. Nachdem das Schiffchen in die Röhre gelegt, regelt man den Gaszufluſs
in oben angegebener Weise und gibt ihm gleichzeitig eine ziemliche Geschwindigkeit.
Es genügt, wenn die durch eine enge Glasröhre austretenden Blasen getrennt
aufsteigen. Nachdem die in der Porzellanröhre vorhanden gewesene Luft verdrängt ist,
was ziemlich schnell der Fall, zündet man die Flamme an, ohne vorerst das Gebläse
wirken zu lassen. Etwas später gibt man so viel Wind, bis Rothglut erzielt ist. Nach
2 bis 2½ Stunden ist fast aller Schwefel in Form von Schwefelwasserstoff entwichen,
und es genügt, um die letzten Spuren wegzutreiben, die Operation um ½ Stunde zu
verlängern. Das gefällte Schwefelsilber wird auf einem doppelten, vorher mit heiſsem
Wasser ausgewaschenen und auf 100° getrockneten Filter abfiltrirt. Durch die
Differenz der beiden Filter könnte man die Schwefelverbindung abwiegen und den
Schwefel daraus berechnen. Es ist jedoch vorzuziehen, die beiden Filter in einem
Porzellan- oder Platintiegel bei Rothglut getrennt zu verbrennen; das aus der
Gewichtsdifferenz der beiden Filter erhaltene Silber multiplicirt mit 0,148 gibt die
Menge des Schwefels. Das verbrannte Filter kann auch mit einem kleinen Bleiblättchen
abgetrieben und das erhaltene Silberkügelchen allein gewogen werden. Dasselbe ist
jedoch meistens sehr klein und, ohne daſs Aschenbestandtheile an demselben hängen
bleiben, schwierig aus der Kapelle zu entfernen. Im Uebrigen geben diese 3
Gewichtsmethoden unbedeutende Abweichungen und wir ziehen vor, die Differenz der
beiden verbrannten Filter zu wiegen. Das Abtreiben kann erforderlichen Falles zur
Controle dienen, um sich zu vergewissern, daſs nach dem Verbrennen nur das Silber
der Schwefelverbindung und die Asche des Filters vorhanden war.
Steht kein Gas oder anderes Brennmaterial zur Verfügung, welches eine leichte
Regelung der Temperatur gestattet, so ist es nothwendig, der zu untersuchenden
Substanz Thonerde, die frei von Schwefel sein muſs, beizumengen, um, wenn die
Temperatur augenblicklich zu hoch geworden, eine Sinterung zu vermeiden, welche
später die Bildung und Entweichung von Schwefelwasserstoff aufhalten oder doch
verzögern würde. Es genügt dazu 1g Thonerde auf
2g Metall. Die dazu nöthige, von Schwefel
freie Thonerde verschafft man sich durch Glühen der von Ammoniakalaun erhaltenen
Thonerde in der stärksten Weiſsglühhitze. Um sich zu überzeugen, ob aller Schwefel
verschwunden ist, glüht man einige Gramm in einem Gasgemisch von Wasserstoff und
Kohlensäure. Sollte sich Schwefelwasserstoff noch in kleiner Menge bilden, so
vollendet man die Reinigung in der Porzellanröhre.Sollte man bei Roheisen, Eisen und Stahl nicht über genügend feine Proben
verfügen können, so operirt man mit dem durch Auflösen des Metalles in
Salzsäure entstandenen Gase. Der Apparat ist dann nur durch Hinzufügenzweier
kleiner Ballons an die letzte Waschflasche zu vervollständigen. Die
Auflösung der 2 bis 4g Metall geschieht in
dem ersten dieser Ballons, d.h. demjenigen dem zuerst das Gasgemisch
zugeführt wird. Der zweite Ballon enthalt etwas Wasser, um etwa mit
übergegangene Salzsäure zurückzuhalten. Zum vollständigen Gelingen der
Operation ist es erforderlich, den Ballon, in welchem die Auflösung
erfolgte, ziemlich lange, sowie zur vollständigen Vertreibung der letzten
Spuren Schwefelwasserstoff den Waschballon leicht zu erhitzen. Die Resultate
sind alsdann dieselben, als wenn man fein zertheilte Substanz in der
Porzellanröhre mit Wasserstoff und Kohlensäure behandelt hätte. Die
Bestimmung ist dabei etwas kürzer, verlangt umgekehrt aber mehr Sorgfalt;
sie ist überhaupt nur dann vorzuziehen, wenn man, wie oben angegeben, über
nicht genügend zerkleinerte Substanz verfügt.
Nachstehend einige Resultate (Procent) über Schwefelbestimmungen in Stahl, Roheisen
und Walzeisen, welche nach dieser Methode ausgeführt wurden:
Bessemer-stahl
Beschickung A
Beschickung B
Beschickung C
VorEntkoh-lung
NachEntkoh-lung
NachWieder-kohlung
VorEntkoh-lung
NachEntkoh-lung
NachWieder-kohlung
VorEntkoh-lung
NachEntkoh-lung
NachWieder-kohlung
1. Probe
0,041
0,043
0,045
0,030
0,046
0,042
0,027
0,040
0,030
2. Probe
0,043
0,042
0,044
0,027
0,044
0,041
0,025
0,045
0,034
3. Probe
0,042
0,043
0,045
0,029
0,044
0,041
0,025
0,040
0,033
Der verschiedene Gehalt an Schwefel der 3 Proben von den
Beschickungen B und C
rührt namentlich her von dem Grade der Reinheit der Beschickung im Augenblick der
Probenahme, wie auch von dem am Ende der Operation zugesetzten Mangan, welches je
nach den Umständen eine mehr oder weniger entschwefelnde Einwirkung ausübt, die
gleich Null sein kann, oder gar negativ erscheint (Beschickung A) je nach den
Bedingungen des Betriebes. Diese Bedingungen hier zu entwickeln, würde zu weit
führen.
Im Allgemeinen kann man jedoch annehmen, daſs von Anfang der Operation der Schwefel
des Roheisens an die Schlacke abgegeben wird, dann von der Schlacke an das Metall
(Beschickung B und C) und häufig durch das zugesetzte Mangan wieder vom Metall an
die Schlacke (fühlbar in Beschickung C).
Roheisenund Eisen
Bessemer-Roheisen
Puddel-Roheisen
Puddeleisen
Nr. 3
Nr. 4
Nr. 5
X
Y
Z
x
y
z
1. Probe
0,012
0,047
0,085
0,180
0,094
0,043
0,074
0,018
0,015
2. Probe
0,012
0,043
0,085
0,186
0,100
0,044
0,075
0,019
0,017
Bestimmung des Schwefels in den Erzen, Schlacken und
Zuschlägen. Ist man in Ungewiſsheit, ob die zu untersuchende Substanz bei
der nöthigen Temperatur zusammensintert, so setzt man so viel Thonerde zu derselben,
daſs eine Zusammensinterung auf jeden Fall vermieden wird. Bei den meisten Erzen und
Schlacken genügt eine Mischung von 2g Thonerde mit
4g Substanz; Hohofenschlacke jedoch, sowie die
kalkigen und
kieseligen Zuschläge erfordern keine Beimischung. Die anderen Einzelheiten des
Versuches sind dieselben, wie früher angegeben.
Erze u. dgl.
Mokta
Elbe
Bell
Mazenay
Danemora
Bessemer-schlacke
PuddelschlackeEisen Nr. 6
HohofenschlackevonBessemereisen
KalksteinvonMazenay
KalksteinvonChagny
1. Probe
0,022
0,085
0,012
0,208
0,372
0,070
0,118
1,580
0,325
0,027
2. Probe
0,024
0,085
0,012
0,198
0,378
0,075
0,125
1,564
0,314
0,026
Bestimmung des Schwefels in den Brennmaterialien, Zur
Bestimmung des Schwefels in Kokes genügt 0g,5
Substanz, der man zur Vorsicht 0g,2 Thonerde
zufügen kann, um ein Zusammensintern der Asche zu vermeiden. Das Verfahren ist
dasselbe wie vorher- es darf jedoch nicht eher als beendet angesehen werden, bis
aller Kohlenstoff verbrannt ist. Zur Untersuchung der Kohlen genügt ebenfalls 0g,5 Substanz. Da die bei der Verbrennung sich
bildenden theerigen Bestandtheile, welche sich in dem kälteren Theil der Röhre
ansetzen, Schwefel zurückhalten, so muſs darauf Bedacht genommen werden, den kalten
Theil der Röhre so kurz wie möglich zu halten; gleichzeitig wird derselbe mit
Porzellanstücken ausgefüllt, um die theerigen Bestandtheile zurückzuhalten. Am Ende
der Operation, d.h. wenn kein Kohlenstoff mehr in dem Schiffchen vorhanden ist,
erhitzt man die Röhre nach und nach stärker, um die theerigen Bestandtheile zu
verbrennen oder zu zersetzen. Bei Bestimmung des Schwefels in Brennmaterialien,
welche stark Schwefel und Phosphor haltig sind, empfiehlt es sich, das
Platinschiffchen durch ein Porzellan Schiffchen zu ersetzen.
Kohlen und Kokes
Kohle vonSt. Etienne(Treuil)
AnthracitvomCreuzot
KokevonMontmartre
KokevomCreuzot
KokevonBlanzy
KokevonBesseges
1. Probe
0,926
0,755
1,361
0,825
0,595
1,164
2. Probe
0,932
0,750
1,380
0,834
0,608
1,149
Handelt es sich um die Bestimmung des Schwefels in einem Gase, so mischt man demselben, je nachdem es eine reducirende oder
oxydirende Wirkung hat, entweder Kohlensäure bei, um eine leichtere Zersetzung der
Kohlenstoffverbindungen herbeizuführen, oder aber Wasserstoff, um die Bildung von
Schwefelwasserstoff zu ermöglichen; das Ganze wird dann durch eine rothglühende
Porzellanröhre geleitet.
Bei den Brennmaterialien und mehreren Erzen kommt es häufig vor, daſs das gebildete
Schwefelsilber nicht ganz rein ist, sondern von Chlorsilber und Cyansilber und ganz
selten auch von metallischem Silber begleitet wird. Man reinigt es, indem man
entweder nach Decantation der gröſsten Menge der schwach angesäuerten Silberlösung,
in welcher sich der
Niederschlag gebildet hat, den kleinen Rest ammoniakalisch macht und während einiger
Zeit digerirt, oder aber man behandelt den vom Filter abgetrennten Niederschlag in
einer Glasröhre bei beginnender Rothglut und führt Wasserstoff im Ueberschuſs zu.
Der gebildete Schwefelwasserstoff wird in eine Lösung von Chlorsilber oder
ammoniakalische Lösung von Silbernitrat geleitet, wo sich reines Schwefelsilber
bildet, aus welchem man unter Berücksichtigung des am Filter hängen gebliebenen
Niederschlages den Schwefel berechnet.
Tafeln