| Titel: | Technisch-chemische Verfahren und Apparate. |
| Autor: | Sachse |
| Fundstelle: | Band 267, Jahrgang 1888, S. 315 |
| Download: | XML |
Technisch-chemische Verfahren und
Apparate.
(Patentklasse 12. Fortsetzung des Berichtes Bd.
266 S. 590.)
Mit Abbildungen auf Tafel
15.
Technisch-chemische Verfahren.
Bekanntlich enthalten die Waschwässer der Wollwäschereien oder Kämmereien vorwiegend
Wollfett, Seife und kohlensaures Alkali. Bei der vielfach üblichen Fällung derselben
durch eine neutrale Chlorcalciumlösung enthält der erzeugte Niederschlag neben
Kalkseife und Wollfett eine nicht unbedeutende Menge von kohlensaurem Kalk, welcher
von der Umsetzung des Chlorcalciums mit kohlensaurem Alkali herrührt. Die Gegenwart
des kohlensauren Kalkes aber vergröſsert die Masse des Niederschlages und verzögert
die Trennung des letzteren von der Flüssigkeit. Ferner muſs zur Zersetzung der
Kalkseifen, wie sie zur Gewinnung der Fettsäuren nach Abscheidung des unverseiften
Fettes aus dem Niederschlag erforderlich ist, dem Gehalt an kohlensaurem Kalk
entsprechend, so viel mehr Salzsäure hierzu verwendet werden. W. Graff in Lesum bei Bremen (D. R. P. Nr. 41557 vom
16. September 1886) vermeidet diesen Niederschlag von kohlensaurem Kalk dadurch
vortheilhaft, daſs er der Chlorcalciumlösung von vornherein diese überschüssige
Menge Salzsäure zusetzt, um dadurch das vorhandene kohlensaure Alkali in Chloralkali zu
verwandeln. Natürlich darf nur ebenso viel Salzsäure hinzugefügt werden, daſs die
Waschwässer nach der Fällung neutral, keinesfalls aber sauer reagiren, da sonst die
Fällung der Fettsäuren als Kalkseifen theilweise verhindert werden würde. Bei der im
Verlauf der weiteren Operationen nöthigen Zersetzung der abgeschiedenen und
gereinigten Kalkseifen wird dann so viel Salzsäure im Ueberschuſs verwendet, daſs
dadurch sogleich die zum Fällen wieder zu benutzende saure Chlorcalciumlösung
erhalten wird. Gegenüber dem Fällen der Wollwaschwässer mit Kalkmilch hat das Fällen
mit Chlorcalcium den Vorzug, daſs die vom Niederschlag abgeführten Wässer nur
unschädliche Alkalichloride enthalten, während die vom Kalkfällverfahren erst von
ihrem Aetzalkaligehalt befreit werden müssen.
Dr. A. Jolles in Breslau (D. R. P. Nr. 41348 vom 28.
Oktober 1886) gibt ein bisher noch nicht verwendetes Bleich- und Oxydationsmittel, das mangansaure
Blei, sowie ein Verfahren zur Herstellung und Regenerirung dieses wenig
bekannten Manganates an.
Das mangansaure Blei, welches durch Fällung einer Lösung von essigsaurem Blei mit
mangansaurem Kali in dem Aequivalentverhältnisse dargestellt wird, wird mit Wasser
zu einem Brei verrieben und der kochenden Flüssigkeit so lange zugesetzt, bis sie
entweder völlig oxydirt ist oder ihr Farbstoff genügend gebleicht erscheint. Es
bildet sich manganigsaures Blei PbMnO3, welches sich
rasch zu Boden setzt und durch Filtration entfernt werden kann. Das manganigsaure
Blei ist in neutraler und alkalischer Flüssigkeit völlig unlöslich, so daſs keine
Spur von Blei in der gebleichten oder oxydirten Flüssigkeit nachgewiesen werden
kann, während dies bei dem mangansauren Baryt, der zu ähnlichen Zwecken
vorgeschlagen wurde, nicht der Fall ist. Der mangansaure Baryt erfährt während des
Oxydirens oder Bleichens einer Flüssigkeit eine fortwährende Zersetzung unter
Bildung von löslichem Bariumhydroxyd (BaH2O2), was zur Folge hat, daſs der sich zu Boden
setzende Niederschlag zum gröſsten Theile aus Mangansuperoxydhydrat (MnO2+H2O) besteht und
natürlich nicht mehr durch Erhitzen an der Luft zu mangansaurem Barium regenerirt
werden kann.
Das zu Boden fallende manganigsaure Blei dagegen, welches in neutraler und
alkalischer Flüssigkeit nicht die geringste Zersetzung erleidet, nimmt beim Erhitzen
an der Luft oder unter Mitwirkung überhitzten Wasserdampfes den beim Bleichen
verloren gegangenen Sauerstoff wieder auf und wird der Hauptsache nach wieder in
mangansaures Blei PbMnO4 verwandelt.
Das mangansaure Blei hat eine chokoladenbraune Farbe, welche beim Erhitzen auf etwa
150°, bei welcher Temperatur das chemisch gebundene Wasser entweicht, in eine
dunkelbraune übergeht. Beim Erwärmen geringer Mengen Bleimanganates mit verdünnter
Salpetersäure tritt, wie bei allen Manganaten, purpurrothe Färbung, von der Bildung von
Uebermangansäure herrührend, auf. Bei Gegenwart von Salzsäure oder von Chlormetallen
tritt diese Reaction nicht ein. Concentrirte Schwefelsäure entwickelt aus
Bleimanganat beim Erwärmen Sauerstoff, zunächst unter Bildung von Bleisulfat und
Mangansuperoxyd, bis auch letzteres unter Abgabe von Sauerstoff in Mangansulfat
verwandelt wird.
Zur Bestimmung des Kohlenstoffes im Eisen wird nach einer neueren Methode das Eisen
im Chlorstrom geglüht, wobei dasselbe in Form von Eisenchlorid entweicht, während
der Kohlenstoff im Schiffchen zurückbleibt und aus diesem direkt verbrannt wird.
Diese analytische Methode hat die Chemische Fabrik
Goldschmieden, H. Bergius und Co. in Goldschmieden (D. R. P. Nr. 40393 vom
10. Juli 1886) zu einem technischen Verfahren zur Befreiung
Eisen haltiger Körper von ihrem Eisengehalt unter eventueller Gewinnung von
Aluminiumchlorid (-Bromid, -Jodid) ausgebildet. Zu dem Zwecke werden die
Eisen haltigen Materialien in Retorten, Muffeln oder ähnlichen Apparaten so lange
einem Glühprozeſs unterworfen, bis das etwa vorhandene Wasser u.s.w. entfernt ist.
Hierauf leitet man über die glühende Masse zugleich mit einem Strom von Kohlenoxyd
einen solchen von Chlorgas. Durch das Kohlenoxyd wird das vorhandene Eisenoxyd unter
Bildung von Kohlensäure zu Eisen reducirt. Letzteres verbindet sich mit dem Chlor zu
wasserfreiem Eisenchlorid, welches sublimirt und in einer Vorlage aufgefangen
wird.
Anstatt das zur Reduction nöthige Kohlenoxyd besonders darzustellen, kann man die
Entstehung des letzteren durch Mischen der Materialien mit Kohle und Darüberleiten
von geringen Mengen atmosphärischer Luft bewirken; oder man mischt die Materialien
mit Kohle, glüht und leitet in die Retorten u.s.w. Kohlensäure und Chlor. Letzteres
kann auch durch Salzsäure ersetzt werden, doch geht in diesem Falle die Reaction
nicht so schnell vor sich, als bei Anwendung von Chlor.
Eine weitere Modification des Verfahrens ergibt sich, wenn die Materialien mit Kohle
und einem Salz, welches leicht Chlor bezieh. Salzsäure frei gibt, gemischt werden,
so daſs die zur Eisenchloridbildung nöthigen Bestandtheile gewissermaſsen in statu
nascendi auf das Eisen einwirken. An Stelle des Kohlenoxydes kann Wasserstoff
treten, ebenso wie statt des Chlors in allen Fällen Jod, Brom oder die
entsprechenden Haloidsäuren verwendet werden können.
Behufs Verarbeitung der Thonerde, welche in der so vom Eisen gereinigten Masse etwa
enthalten ist, wird dieselbe den fortgesetzten Einwirkungen von Kohlenoxyd und Chlor
bezieh. Brom oder Jod ausgesetzt, oder nach einem der oben genannten ähnlichen
Verfahren weiter verarbeitet. Hierbei bildet das Chlor bezieh. Brom oder Jod mit der
in dem Rohmaterial enthaltenen Thonerde, sobald der letzte Rest Eisen aus demselben
entfernt ist, wasserfreies Chloraluminium u.s.w. Hatte man die Thonerde mit anderen
Salzen, z.B. Kochsalz, gemischt, so erhält man als Sublimat die entsprechenden Doppelverbindungen.
Nach diesem Verfahren sollen Eisen haltige Thone und Bauxit, Eisen haltiger
Feldspath bezieh. Fluſsspath u.a. von Eisen befreit werden.
Die hohe Temperatur, welche man mittels des elektrischen Stromes erzeugen kann, ist
bereits von Siemens (vgl. Berg-
und Hüttenmännische Zeitung Bd. 42 S. 66) bei
dessen elektrischem Schmelzofen zum Erzschmelzen verwendet und in neuerer Zeit von
Cowles (vgl. 1887 265 *
550) zur Reduction von Metalloxyden, namentlich zur Herstellung von Aluminium,
angeblich in gröſserem Maſsstabe verwerthet worden. Hierbei läſst man den Lichtbogen
zwischen zwei Kohlenelektroden überspringen, welche in einer Retorte von dem zu
reducirenden Material (Thonerde und Kohle) umgeben sind. Es leuchtet ein, daſs bei
der Reduction schwer schmelzbarer Erze dieselbe vornehmlich in der Nähe des
Lichtbogens stattfinden wird, während der übrige Inhalt wenig davon berührt werden
wird, da die in Betracht kommenden Substanzen sehr schlechte Wärmeleiter sind und so
hohe Schmelztemperaturen besitzen, daſs eine Verflüssigung des ganzen Tiegelinhaltes
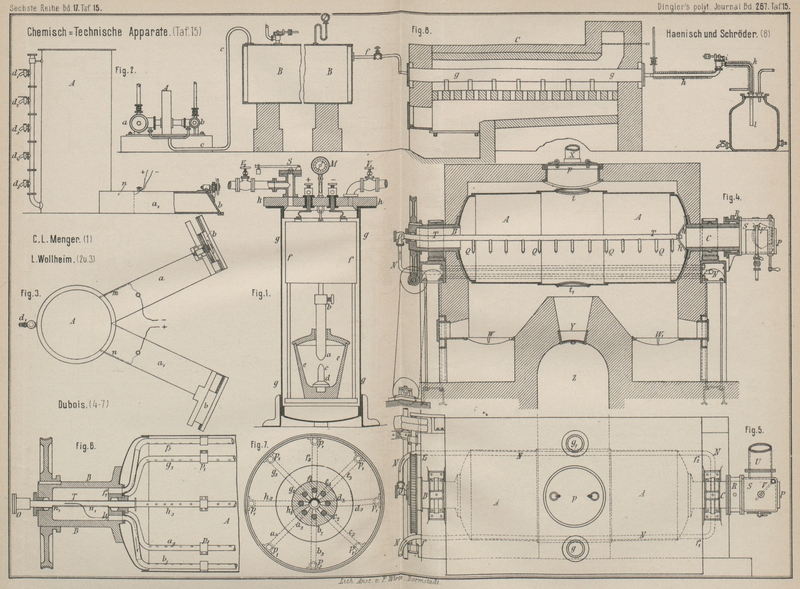
nicht möglich ist. C. L. R. E. Menges im Haag (* D. R.
P. Nr. 40354 vom 16. Januar 1886) sucht diese Uebelstände bei seinem Verfahren zur
Reduction oder Dissociation von Verbindungen mittels
elektrischer Glühhitze dadurch zu beseitigen, daſs er aus den zu
reducirenden Substanzen und elektrisch gut leitender Kohle mit Hilfe geeigneter
Bindemittel Stäbe oder Platten bildet und wie die Kohlenelektroden elektrischer
Bogenlichtlampen durch den elektrischen Strom zum Glühen bringt, wobei die bei
solchen Lampen gebräuchliche Glaskugel durch einen feuerfesten, den freien Zutritt
der Luft abhaltenden Mantel um den glühenden Theil ersetzt wird. In Fig. 1 Taf. 15 ist ein zur
Ausführung des Verfahrens geeigneter Apparat dargestellt. Im Kasten f ist der Mechanismus, welcher zur Bewegung der aus dem
zu reducirenden Material, z.B. Aluminium-, Nickel-, Kobalt-, Chrom- oder Manganoxyd
und Kohle hergestellten Elektrode ab dient,
untergebracht, um denselben vor Beschädigung zu schützen. Die andere Elektrode cd steht fest und ist nur aus Kohle gebildet, wodurch
ein langsameres Abnutzen derselben bewirkt wird. Ein Schmelztiegel ee aus Graphit oder feuerfestem Thon mit einem für den
Hindurchtritt der Elektrode ab durchlochten Deckel
umschlieſst die Elektroden. Bei der Reduction leicht flüchtiger Erze, z.B. solcher
von Blei, Zinn, Zink, empfiehlt sich die Anwendung von Druck; zu dem Ende wird der
ganze Apparat in einen Kessel gg eingesetzt und an den
Deckel hh luftdicht angeschlossen, so daſs man ihn nach
Abschrauben dieses Deckels leicht entfernen, neue Elektroden einsetzen und die
dargestellte Substanz aus dem Tiegel ee herausnehmen
kann. Auf dem Deckel sind ferner die gewöhnlichen Armaturen für Kessel, die unter
Druck stehen, angebracht: Manometer M,
Sicherheitsventil S, Ventile V1 und V2 zum eventuellen Einlassen reducirender Gase und
zum Auslassen der Reactionsgase. Ist die Substanz nicht zu flüchtig, so genügt die
dargestellte Einrichtung, indem der Tiegel ee
verhältniſsmäſsig kalt bleibt, sonst muſs der Tiegel durch eine Retorte mit Vorlage
ersetzt werden, oder man theilt den Tiegel durch eine horizontale Scheidewand in
zwei Theile. Die durch den höheren Druck bedingte geringere Flüchtigkeit bewirkt ein
besseres Zusammenflieſsen und macht auch, daſs die abziehenden Gase weniger von der
hergestellten Substanz mit sich führen. Wird bei Herstellung der Reductionselektrode
eine Mischung verschiedener Metalloxyde, z.B. Aluminium- und Kupferoxyd, verwendet,
so erhält man wie bei dem Verfahren von Cowles die
entsprechenden Metalllegirungen, Bronzen u.s.w.
Ein elektrolytisches Scheideverfahren nicht elektrolysirter
Stoffe von einem Bestandtheil elektrolytisch zersetzter Stoffe in Lösungen
beschreibt L. Wollheim in Wien (* D. R. P. Nr. 41714
vom 22. August 1886); dasselbe soll im Besonderen zur Trennung des Zuckers der
Melassen von den Alkalien dienen. Die betreffenden Zucker haltigen Lösungen befinden
sich in einem Reservoire! (Fig. 2 und 3 Taf. 15) in beliebiger,
durch die Hähne d1, d2 u.s.w. regulirter,
aber constanter Höhe; der Abfluſs erfolgt durch zwei Kanäle a und a1,
deren Ausfluſsöffnung sich durch Schieber b (wie bei
a gezeichnet) vergröſsern und verkleinern läſst.
Zunächst der Abzweigungsstelle dieser Kanäle sind die Elektroden m und n angebracht. Je
mehr die Abfluſsmenge von der Kathodenseite, nach welcher sich das Aetzkali begibt,
gegenüber jener von der Anodenseite, an welcher sich der von Aetzkali befreite
Zucker ansammelt, vermindert wird, in desto concentrirterem Zustande wird dort das
Aetzkali und in desto gröſserer Menge wird hier der von Aetzkali befreite Zucker
erhalten werden. So soll z.B. bei der Scheidung einer Lösung, welche 3 Proc.
Aetzkali und 20 Proc. Zucker enthält und bei dem günstigsten Verhältniſs zwischen
dem Abfluſs von der Anoden- und dem von der Kathodenseite von 9 : 1, das gesammte
(?) Aetzkali mit nur mehr 2 Gew.-Th. Zucker von der Kathodenseite und 18 Gew.-Th.
Zucker ohne eine Beimengung von Aetzkali (?) von der Anodenseite aufgefangen werden
können.
A. Feldmann in Linden vor Hannover (D. R. P. Nr. 41717
vom 26. Januar 1887) stellt Fluormagnesium anstatt
durch Behandeln von Magnesia mit Fluſssäure oder durch Zersetzung von Magnesiasalzen
mit Fluoralkalien, wie bisher üblich, durch Umsetzen von Chlormagnesiumlauge mit
Fluorcalcium in der Hitze dar. Gegen Ende des Prozesses kann die Temperatur bis zur
theilweisen Zersetzung des überschüssigen Chlormagnesiums gesteigert werden; doch
ist dann beim Weiterverarbeiten der erstarrten Masse ein Aufweichen mit verdünnter
Salzsäure nöthig, um die ausgeschiedene Magnesia und das Chlorcalcium von dem
unlöslichen Fluormagnesium durch Auswaschen zu scheiden; ein vorhandener Ueberschuſs
des unlöslichen Fluorcalciums wird von dem voluminöseren Fluormagnesium durch
Schlämmen abgesondert. Das Fluormagnesium dürfte zur Milchglasfabrikation Verwendung finden können.
Um das Abtreiben des Schwefels aus Schwefel haltigen Mineralien, Erden u.s.w. mittels überhitzten Wasser dampf es, was schon früher von Dubois vorgeschlagen ist, praktisch ausführbar zu
machen, hat derselbe einen neuen Destillirapparat (* D.
R. P. Nr. 41718 vom 8. Februar 1887) angegeben. Derselbe besteht aus einem
metallenen Behälter A (Fig. 4 und 5 Taf. 15), welcher in
einem aus Mauerwerk bestehenden Mantel um die hohlen
Achsen B und C drehbar
gelagert ist. Die Verbrennungsproducte der beiden Feuerungen W und W1
umspülen sowohl den Behälter A als auch das den
letzteren umlaufende, als Ueberhitzer dienende Dampfrohr N, welches bei f in den Heizmantel ein-, bei
f1 aus-, bei f2 wieder ein- und f3 wieder austritt, um
sodann mittels der Leitung O den überhitzten Dampf
durch die hohle Achse B in das mit zugespitzten
Ausströmungsröhrchen Q versehene Dampfvertheilungsrohr
T zu leiten; das letztere wird an seinem Ende von
einer Querschiene h getragen. Die Verbrennungsproducte
verlassen den Heizmantel durch Schornsteine x, welche
auf die Oeffnungen g und g1 des Mantels aufgesetzt sind. Die
Schwefel haltigen Mineralien u.s.w. werden durch die Oeffnung p des Mantels und t des
Behälters A eingetragen und die entschwefelten
Mineralien durch die entsprechenden Oeffnungen t1 und Y in den
Abkühlraum Z entleert.
Der Austritt der erzeugten Schwefeldämpfe und des Wasserdampfes erfolgt durch die mit
Stopfbüchse R versehene hohle Achse C und dann durch die zur Dampfvertheilung nach dem
Hauptrohr P oder dem Nebenrohr U vorgesehene Büchse S. Ein in letzterer
angebrachter Schieber V verschlieſst je nachdem das
Rohr P oder U, falls eine
besondere Auffangung etwa vor dem Schwefel entweichender Destillationsproducte
erforderlich wird. Der drehbare Destillationsbehälter A
kann anstatt von cylinderförmiger Gestalt aus zwei abgestumpften, mit ihrer Basis an
einander liegenden Kegeln bestehen, wodurch das in demselben befindliche Material in
Folge der Drehung und der Neigung der Behälterwände von selbst nach der Mitte des
Apparates behufs Entleerung geschafft wird. An Stelle des centralen
Dampfzuführungsrohres T mit Zweigröhrchen Q soll bei Verarbeitung von Schwefelerzen u.s.w., bei
welchen kein Mitreiſsen von Theilchen zu befürchten ist, welche die Reinheit des
Schwefels beeinträchtigen könnten, eine Vorrichtung angebracht werden, durch welche
der Dampf die Materialien von unten her durchströmt; dieselbe ist in Fig. 6 und 7 dargestellt.
Die mehrere Kammern (z.B. acht) bildende Achse A
empfängt den Dampf des centralen Rohres T durch einen
groſsen Längenschlitz n1
n1
, welcher sich an der unteren Seite des Rohres
befindet.
Die Kammern sind gegen den Behälter A hin durch eine
Scheibe verstopft, welche mit einer Anzahl Löcher (z.B. acht) a2
b2
c2
d2
e2
f2
g2
h2 versehen ist, von
welchen jedes eine Röhre a3
b3
c3
d3
e3
f3
g3
h3 aufnimmt: diese
Röhren sind durch Bänder p1 an den Wänden des Behälters befestigt und zur Vertheilung des überhitzten Dampfes mit
Löchern versehen.
Dreht sich nun der Behälter, während das centrale Dampfzuführungsrohr T fest bleibt, so treten die Oeffnungen von je drei
Kammern nebst den dazu gehörigen Oeffnungen, z.B. a2
b2
c2 vor den Schlitz n1
n1 von T, während von den anderen fünf Oeffnungen (wie d2
e2
f2
g2
h2) der Dampf
abgeschlossen ist. Hierdurch erhalten auch nur die Röhren a3
b3
c3 Dampf, während die
Röhren d3
e3
f3
g3
h3 keinen erhalten und
inactiv bleiben.
Der Ort, wo die Arbeit des Dampfes stattfindet, ist inmitten des zu behandelnden
Materiales, da der durch die unteren Röhren eintretende Dampf das Material von unten
nach oben durchstreicht, während kein Dampf von oben eintritt, da alle anderen
Röhren abgeschlossen sind. Dieses intermittirende Spiel, welches in der Mitte der
Materialien lokalisirt ist, bewirkt eine gründliche Durchstreichung der Materialien
und Gewinnung des Schwefels.
Die Vereinigung von schwefliger Säure und Sauerstoff zu Schwefelsäureanhydrid
geschieht, wie bekannt, durch Ueberleiten des schweflige Säure und Sauerstoff
haltigen Gasgemisches über Platinschwamm oder andere wirksame Contactsubstanzen bei
schwacher Rothglut. Zur Erreichung eines besseren Effectes hat man das Platin auf
Asbest oder andere geeignete Substanzen mit groſser Oberfläche übertragen, um auf
diese Weise beim Ueberleiten der zu vereinigenden Gase eine möglichst lange
Berührungsdauer mit dem Platin zu erzielen. Es ist dies Verfahren besonders von Winckler in Freiberg zur Unschädlichmachung und
gleichzeitigen Verwerthung der schwefligen Säure des Hüttenrauches mit Vortheil in
die Praxis eingeführt worden (vgl. Zeitschrift für Berg-,
Hütten- und Salinenwesen Bd. 29 S. 428). E.
Haenisch in Rosdzin, O.-Schl., und Dr. M.
Schröder in Neumühl-Hamborn, Rheinland (D. R. P. Nr. 42215 vom 1. Februar
1887) verlängern neben der Anwendung einer möglichst groſsen Platinoberfläche die
Berührungszeit noch dadurch, daſs das Volumen des schweflige Säure und Sauerstoff
haltigen Gasgemisches während der Dauer des Ueberleitens über die Platin Substanz
durch Anwendung höherer Spannung wesentlich vermindert wird. Wendet man hierbei
beispielsweise eine dreifache atmosphärische Spannung an, so wird das Gas auf den
dritten Theil seines ursprünglichen Volumens verdichtet und wird dementsprechend die
dreifache Zeit in dem mit platinirter Substanz angefüllten Raum verweilen, als wenn
es mit gewöhnlicher atmosphärischer Spannung hindurchstreicht. Auſserdem geht auch
der chemische Prozeſs an sich unter dem Einfluſs der höheren Spannung besser vor
sich, da die chemisch activen Gasmoleküle näher an einander liegen.
Ist das Gemisch von schwefliger Säure und Sauerstoff nicht in dem zur Bildung von
Anhydrid günstigen Mischungsverhältniſs von etwa 25 Vol.-Proc. schwefliger Säure
und 75 Vol.-Proc. Luft vorhanden, wie solches bei dem durch Zersetzung von
concentrirter Schwefelsäure oder Sulphaten in höherer Temperatur resultirenden
Gasgemisch von schwefliger Säure und Sauerstoff annähernd vorliegt, so muſs dieses
vortheilhafte Mischungsverhältniſs erst künstlich erzeugt werden. Dies geschieht
unter gleichzeitiger Comprimirung der Gase durch den Zwillingscompressor A (Fig. 8). Die beiden
Cylinder desselben a und b
sind in ihren Abmessungen so gewählt, daſs der die Luft ansaugende Cylinder a bei gleicher Hubhöhe einen dreimal so groſsen
Querschnitt hat als der die schweflige Säure ansaugende Cylinder b, so daſs also beim Betriebe des Compressors stets
dreimal so viel Luft als schweflige Säure befördert wird. Die comprimirten Gase
beider Cylinder vereinigen sich im Druckrohr c und
werden durch dieses nach dem Druckkessel B geführt, der
mit einem Sicherheitsventil und einem Manometer versehen ist. Von hier gehen die
gemischten, unter höherem Druck befindlichen Gase durch Rohr und Ventil f in den zur Vereinigung dienenden Ofen C. Derselbe enthält zwei mit der platinirten
Contactmasse gefüllte, auf schwache Rothglut erhitzte schmiedeeiserne Rohre g, welche von der unter Druck befindlichen Gasmischung
gleichzeitig passirt werden. Die Rohre dürfen nur einen verhältniſsmäſsig kleinen
Durchmesser haben und müssen sehr starkwandig sein, damit sie bei schwacher
Rothglut, ohne aufzureiſsen, noch einen Druck von mehreren Atmosphären ertragen
können. Nach dem Passiren der Rohre g, in welchen die
Gase zum gröſsten Theil in Schwefelsäureanhydrid übergeführt sind, vereinigen sich
dieselben wieder in dem gemeinsamen Rohre h und
gelangen nun nach dem Druckentlastungsventil i, welches
so eingestellt ist, daſs es bei dem für die Einwirkung bestimmten Druck (für
gewöhnlich 2 bis 3at) gleichmäſsig die Gase in das
Rohr k abbläst. Damit sich das gebildete Anhydrid nicht
schon in den Rohren h und k oder im Entlastungsventil i absetzen und zu
Verstopfungen Veranlassung geben kann, sind dieselben auſsen mit einer Bleischlange
umwickelt, durch welche Dampf streicht, so daſs die Temperatur immer über dem
Verflüchtigungspunkt des Anhydrids gehalten wird. Sollte dennoch durch zufällige
Veranlassungen eine Verstopfung dieser Rohre oder ein Festsetzen des Abblaseventiles
eintreten, so steigt auch der Druck im Kessel B, und es
tritt alsdann das auf diesem Kessel angebrachte Sicherheitsventil in Function,
welches so eingestellt ist, daſs es etwa bei einer um 1at höheren Spannung abbläst, als bei normalem Verlauf des Prozesses
angewendet werden soll.
Die nach der Umsetzung im Wesentlichen aus Stickstoff und Schwefelsäureanhydrid
bestehenden Gase passiren hierauf eine Reihe von thönernen Condensationsgefäſsen l, welche zur Abscheidung des Anhydrids bezieh. zur
Lösung desselben in gewöhnlicher Schwefelsäure oder Wasser dienen. Die nach
Abscheidung des Anhydrids in den Endgasen noch enthaltene geringe Menge schwefliger Säure
wird in der bisher üblichen Weise durch Ueberführung in Kammersäure nutzbar gemacht
oder auch nach Trennung von dem Stickstoff von Neuem in den Anhydridprozeſs
zurückgeführt. Nach Versuchen von Dr. Knublauch in
Ehrenfeld bei Köln (D. R. P. Nr. 41930 vom 18. August 1886) gestaltet sich die Abscheidung von relativ geringen Mengen Cyanverbindungen aus
Gasen, welche auſserdem Kohlensäure und Schwefelwasserstoff enthalten,
durch Gemische von Alkali, alkalischen Erden oder Magnesia und Eisen, Oxyden oder
Carbonaten desselben wesentlich vortheilhafter, wenn das Gas durch eine Flüssigkeit
(nicht eine feste Masse), welche jene gelöst oder suspendirt enthält, geleitet wird.
Die Ausbeute ist hier deshalb bedeutender, weil das Cyan überall mit Eisen- und
Alkalimolekülen gleichzeitig zusammentrifft, was bei festen Massen nur in sehr
geringem Maſse der Fall ist, nämlich nur an der im Vergleich mit der ganzen Masse
relativ geringen Berührungsfläche der Eisenalkalitheilchen, und das wiederum nur so
weit, als die Oberfläche der Theilchen nicht schon von Kohlensäure und
Schwefelwasserstoff angegriffen ist. Hat die Einwirkung der Gase auf die feste Masse
aber einmal stattgefunden, so hört jede weitere Zersetzung auf, da Cyan oder
Blausäure gebildetes Schwefeleisen oder kohlensaures Alkali nicht zersetzen, während
beim Absorbiren mittels Flüssigkeit das gebildete Doppelcyanür in Lösung geht, immer
wieder neue Zersetzung stattfindet, und nur sehr geringe Mengen von Kohlensäure und
Schwefelwasserstoff mit absorbirt werden. Die Versuche zeigten nämlich, daſs beim
Durchleiten von Cyan haltigen Gasen selbst mit sehr groſsen Ueberschüssen an
Kohlensäure und Schwefelwasserstoff durch eine Flüssigkeit, welche gleichzeitig
Alkali- und Eisenverbindungen enthält, das Cyan mit solcher Energie Ferrocyansalz
bildet, daſs die Affinität der Kohlensäure und des Schwefelwasserstoffes gegenüber
dem Cyan so geschwächt wird, daſs nur geringe Mengen von Schwefelwasserstoff
(Kohlensäure) zur Absorption kommen. Die Versuche stellten fest, daſs das
Verhältniſs des absorbirten Cyans zu dem absorbirten Schwefelwasserstoff ein ganz
bestimmtes ist, nur von dem Verhältniſs des in der Flüssigkeit befindlichen Alkalis
zum Eisen und den Verbindungsformen von Alkali und Eisen selbst, aber unabhängig von
den Ueberschüssen an Kohlensäure und Schwefelwasserstoff zu dem vorhandenen Cyan. Es
ist nach dem Verfahren möglich, das Cyan zu binden und nur einen Bruchtheil vom Cyan
an Schwefelwasserstoff zur Absorption zu bringen. Leitet man z.B. ein Cyan,
Kohlensäure und Schwefelwasserstoff haltiges Gas durch eine Flüssigkeit, in welche
Eisenoxydulsalz und Alkali in dem für den Versuch am günstigsten Verhältniſs
eingetragen sind, so verschwindet nach und nach das gefällte Eisenoxydulhydrat
vollständig, indem der gröſste Theil desselben als Ferrocyanalkali in Lösung geht,
während nur ein bestimmter Bruchtheil desselben als Schwefeleisen in der Lösung
suspendirt bleibt.
Während also beim Absorbiren mit festen Massen das gebildete Ferrocyan zu der ganzen
Masse verschwindend klein, ist hier umgekehrt der gröſste Theil des Alkalieisens in
Ferrocyan übergeführt.
Während nun bei festen Massen die geringen Mengen Doppelcyanür ausgelaugt werden
müssen, resultirt hier direkt eine an Doppelcyanür sehr reiche Flüssigkeit, welche
vom Ungelösten getrennt und weiter verarbeitet wird. Ist ein gewisser Ueberschuſs
von Eisen zum Alkali in der Absorptionsflüssigkeit enthalten, so bildet sich neben
dem Doppelcyanür in Lösung gleichzeitig unlösliches Cyanürcyanid, welches dann aus
dem Rückstande gewonnen werden kann. Durch Steigerung des Eisens zum Alkali kann man
es dahin bringen, daſs direkt unlösliches Cyanürcyanid gebildet wird.
Die Menge der Absorptionsstoffe für ein bestimmtes Gewicht Cyan hängt mit davon ab,
ob man mit ein- oder zweiwerthigen Basen, mit Hydraten oder Carbonaten derselben,
mit Eisenoxydulhydrat, Eisenoxydhydrat oder Eisenerzen arbeitet. Im Allgemeinen aber
kann man sagen, daſs beim Operiren mit Eisen und Alkali oder Erden (Magnesia) auf je
1 Mol. vorhandene Blausäure (Cyan) annähernd 1 Mol. Alkali oder Erdalkali, Hydrat
oder Carbonat und bedeutend weniger als 1 Mol. Eisenverbindung in der Flüssigkeit
gelöst oder suspendirt vorhanden sein soll. Bei Eisenerzen und metallischem Eisen
kann dessen Menge entsprechend der geringeren Reactionsfähigkeit überschritten
werden, die Menge des Alkalis aber gleich bleiben.
Bei einem gewissen Schwefelwasserstoffgehalt ändert sich zwar das Verhältniſs, aber
auch da kommen auf 1 Mol. Blausäure (Cyan) am besten annähernd nur 1 Mol. Alkali
(-Erde) und weniger als 1 Mol. Eisenverbindung. Steigt der Schwefelwasserstoffgehalt
beliebig hoch, so ist an Menge und Verhältniſs der Absorptionsstoffe nichts zu
ändern; es wird mit denselben Mengen Eisenalkali das Cyan gebunden, und die
Ueberschüsse von Schwefelwasserstoff gehen unabsorbirt durch die Flüssigkeit. Da bei
Schwefelwasserstoff haltigen Gasen der erstere gegen die Menge des Cyans meist sehr
hoch ist, z.B. bei Kohlendestillationsgasen, so ist auch die
Gesammtschwefelabscheidung nur äuſserst geringfügig und ganz nebensächlich und
unerheblich.
Die Menge der Flüssigkeit soll im Minimum so viel betragen, daſs das Gas durch Druck
oder Saugen die Flüssigkeit unter Blasenwerfen durchstreichen kann, oder daſs
Flächen o. dgl. mit der Flüssigkeit berieselt werden können.
Sachse.
Tafeln