| Titel: | Die Wiedergewinnung des Schwefels aus den Sodarückständen durch Kalkofengase; von Alexander M. Chance. |
| Autor: | Alexander M. Chance, P. Behrend |
| Fundstelle: | Band 270, Jahrgang 1888, S. 522 |
| Download: | XML |
Die Wiedergewinnung des Schwefels aus den
Sodarückständen durch Kalkofengase; von Alexander M. Chance.Nach dem Journal of the Society of Chemical
Industry, 1888 Bd. 7 S. 163 ff.
Mit Abbildungen auf Tafel
28.
Chance's Wiedergewinnung des Schwefels.
Schon lange Jahre hatten die Sodafabrikanten ihr Augenmerk auf die Wiedergewinnung
des Schwefels aus den Sodarückständen gerichtet. 1837 begann Goſsage seine 30 Jahre währenden Versuche, jedoch ohne Resultat, nach ihm
widmeten noch viele bedeutende Chemiker der Lösung dieses Problems viel Zeit und
Geld, und einigen, Schaffner in Deutschland, Mond in England, Mactear
in Schottland, gelang es wenigstens Verfahren zu finden, die, wenn sie auch nicht zu
allgemeiner Anwendung tauglich waren, doch in einigen Fabriken ausgeführt
wurden.
Das Verfahren von Schaffner und Helbig wurde in Oldbury eingeführt, und bei einem Kostenaufwande von über
10000 Pfd. St. (200000 M.) gelang es dort nach zwei Jahren, den bis dahin in den
Sodarückständen verlorenen Schwefel als Schwefelsäure wieder zu gewinnen.
Die Kosten stellten sich auf ungefähr 3 Pence (25 Pf.) für die Einheit (14 engl.
Pfund?) Schwefel für 1t spanischer Schwefelkiese
im Vergleiche zu 6 Pence (50 Pf.), die die Schwefelkies-Compagnien forderten. Nachdem jedoch die Tharsis Compagnie den Preis auf 3 Pence herabgesetzt
hatte, wurde der weiteren Einführung des Schaffner und
Helbig'schen Verfahrens ein Stillstand gesetzt und
auch in Oldbury das Verfahren eingestellt; die Anlage blieb jedoch stehen und Chance setzte seine Bemühungen zur Auffindung eines
praktisch anwendbaren Prozesses weiter fort.
Goſsage hatte 1861 geäuſsert: „ich bin überzeugt,
daſs, wenn die Nutzbarmachung des Schwefels in den Sodarückständen erreicht
werden kann, es durch Behandlung mit Kohlensäure geschehen wird.“ Angaben
von Weldon, Mactear und F. H.
Goſsage, welche alle auf Einwirkung von Kohlensäure auf Schwefelcalcium
basirten, konnten jedoch praktisch nicht verwerthet werden, ihre Einführung
scheiterte an der Unregelmäſsigkeit und der immer wechselnden Zusammensetzung des
entwickelten Schwefelwasserstoff haltigen Gasgemisches. Die Ueberzeugung jedoch, die
Goſsage ausgesprochen, daſs durch Kalkofengase die
Wiedergewinnung des Schwefels bewirkt werden könne, ist durch die Versuche von Chance bewahrheitet worden.
Chance sagt in seinem Vortrage: „Diejenigen, welche
dem Laufe unserer Versuche nach Schaffner und Helbig gefolgt sind und die die über diesen
Gegenstand veröffentlichten Arbeiten kennen, wissen, daſs Schaffner und Helbig's
Vorschlag zur Wiedererlangung des Schwefels aus Schwefelwasserstoff durch
Niederschlagen des Schwefels gemäſs der Gleichung: 2H2S + SO2 = 2H2O + 3S nie zu praktischem Erfolge geführt hat, andererseits
das Vorgehen der Pyrit-Compagnien durch
Herabsetzung der Preise des Schwefels nur die Annahme des Schaffner- und Helbig-Prozesses beschränkt, aber nicht zum Stillstande gebracht haben
würde.
Daſs Kohlensäure, wie sie aus dem Kalkofen kommt, das Schwefelcalcium in den
Rückständen zerlegen und Schwefelwasserstoff frei machen würde, hatte Goſsage bewiesen, aber das Problem der ökonomischen
Ausnutzung des so entwickelten Schwefelwasserstoffes blieb ungelöst und Schaffner und Helbig's
Versuch, freien Schwefel zu extrahiren, wurde aufgegeben.
Am 29. April 1883 erschien im Journal of the Society of
Chemical Industry unter Patentliteratur (S. 177) eine Notiz: Ueber die Gewinnung von Schwefel aus
Schwefelwasserstoff von C. F. Claus in
London (Englisches Patent Nr. 3608 vom 29. Juli 1882). Bei diesem Prozesse hat
Claus nur die Reinigung des Steinkohlengases im
Auge und die Wiedergewinnung des Schwefels aus dem Schwefelwasserstoffe in
demselben, aber ich glaubte, daſs es vielleicht möglich wäre, dieses Verfahren
vortheilhaft auf die Wiedergewinnung des Schwefels aus dem Schwefelwasserstoffe,
welcher aus den Sodarückständen durch Kohlensäure frei wird, anzuwenden.
Die Erzeugung des Schwefels geschieht gemäſs der Formel: H2S + O = H2O +
S.
So einfach das Problem auf dem Papiere erscheint, nahm es 4 Jahre Arbeit und einen
Aufwand mehrerer Tausend Pfund in Anspruch, bevor wir im Stande waren, auf
sparsame Weise nach der Claus'schen Methode
Schwefel aus den Sodarückständen zu erzeugen; Schwefel und Schwefelblumen von
einer Beschaffenheit und Reinheit, wie sie den kritischsten Consumenten
genügen.
Betrachten wir zunächst den Claus-Ofen und dann die
Methode und Apparate, durch welche wir Schwefelwasserstoff unter solchen
Bedingungen aus den Alkalirückständen erhielten, daſs der Schwefelwasserstoff
nicht nur zur Gewinnung guten Schwefels, sondern auch für die direkte Erzeugung
von Schwefelsäure geeignet war.
Claus verlangt:
1) Die Anwendung von erhitztem Eisenoxyde zur Absorption von
Schwefelwasserstoff.
2) Das Mischen kalter oder heiſser Luft in regelmäſsiger Menge mit
Schwefelwasserstoff, bevor derselbe durch das Eisenoxyd streicht, um freien
Schwefel zu erhalten, in einem beständigen Strome.
3) Das Innehalten der nöthigen Temperatur, bei der das Eisenoxydanhydrid den
Schwefelwasserstoff aus dem Gemische von Luft mit den Gasen absorbirt und in der
Folge Schwefel abgeschieden wird.
4) Die Aufeinanderfolge der Operationen, die einen fortlaufenden Prozeſs der
Erlangung des Schwefels aus Schwefelwasserstoff und Eisenoxyd bilden.
Bei diesem Prozesse wird nur der Wasserstoff des Schwefelwasserstoffes durch den
Sauerstoff der Luft verbrannt und sein Schwefel frei, H2S + O = H2O +
S.
Man erreicht dies durch das Mischen von Schwefelwasserstoff mit einer regulirten
Menge Luft und Durchsenden dieses Gemisches durch eine Schicht Eisenoxyd, das in
Folge der bei der Reaction frei werdenden Wärme in Dunkelrothglut bleibt; das
Eisenoxyd selbst unterliegt keiner Veränderung. Freier Schwefel und Wasserdampf
gehen fort, der freie Schwefel bekommt gegossene oder sublimirte Form, wenn er
von der Temperatur des Ofens die der umgebenden Kammer angenommen hat.
Durch neue Patente (Oktober und December 1883) wurde die Anwendung von
verschiedenen anderen Oxyden und auch von „Contact-Substanzen“ in
Anspruch genommen und Schutz erhalten für den Gebrauch des Bettes oder Lagers
von angemessenem soliden Materiale, feuerfestem Steine und anderen chemisch
unwirksamen Stoffen u.s.w.
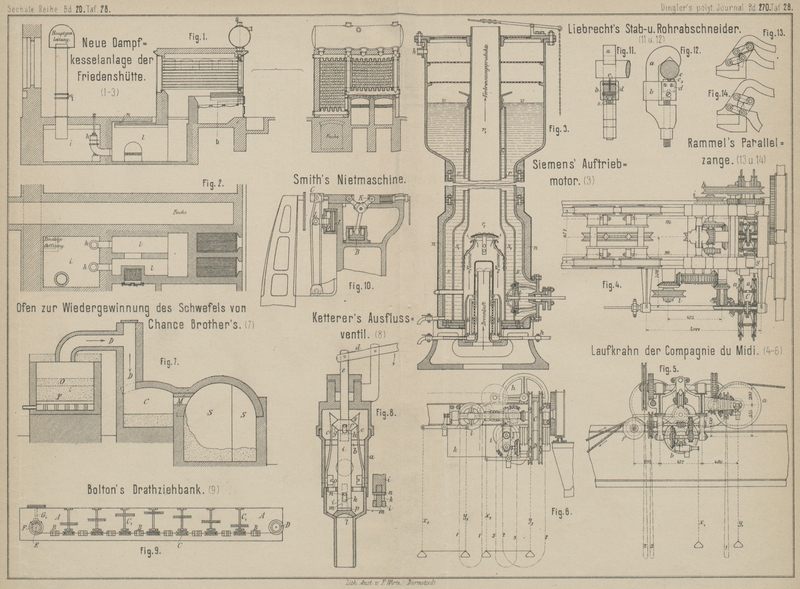
Der Claus-Ofen war folgendermaſsen (Fig. 1):
Durch ein Rohr an der linken Seite der Zeichnung tritt das regulirte Gemisch von
Schwefelwasserstoff und Luft (H2S + O) unter den
durchbohrten Boden des runden Ofens, der mit feuerfesten Steinen ausgelegt ist,
zuerst durch ein Bett von Bruchstücken feuerfester Steine F und dann durch eine Lage von Eisenoxyd O. Bei der schon beschriebenen Reaction werden
Dampf und Schwefeldampf erzeugt, welche durch das auſsen liegende Rohr DD gehen, zuerst in die enge Steinkammer C und dann durch M in
eine weite Steinkammer SS, in der der Schwefel
sublimirt.
Die Hitze der Reaction selbst wird bald hinreichend groſs, um einen Theil des
Schwefeldampfes an dem Boden der Kammer in flüssiger Form zu condensiren, von wo
er abgelassen wird und in Formen läuft. Eine beträchtliche Menge aber des
Schwefeldampfes geht nach SS, wo er in dem ersten
Theile der Kammer allmählich abkühlt und sich als trockene Schwefelblumen
absetzt. Der Dampf wird in dem letzten Theile der „Sublimirungskammer“
condensirt und die austretenden Gase werden nach einfachen Methoden controlirt
ehe sie in die Luft gehen.
Der „Claus-Ofen“, wie der Erfinder ihn nennt,
hängt in seinem Erfolge ab von der „vollständigen Regulirung“ der
Ergänzung an atmosphärischem Sauerstoffe, der, um aus Schwefelwasserstoff
Schwefel frei zu machen, erforderlich ist.
Bei zu groſsem Zusätze von Luft würde schweflige Säure gebildet werden, bei zu
geringem Schwefelwasserstoff hindurch gehen. In dem
vollständig regelmäſsigen und beständigen Hinzufügen von Sauerstoff, so weit
ihn der Wasserstoff zur Bildung von Wasserdampf beansprucht, liegt der
Hauptschlüssel zum Erfolge des Prozesses. Angenommen, eine reguläre
Zufuhr von Gas enthielte Schwefel Wasserstoff in festem und regelmäſsigem
Verhältnisse, so wäre die nothwendige Luftzufuhr leicht zu bestimmen; aber bei einem Gase,
das in immer wechselnden Mengen Schwefelwasserstoff enthält, verschieden bis zu
einer oft unbekannten Höhe, ist es schwierig, ein System zur Regulirung einer
geeigneten Luftzufuhr zu finden. Unter solchen Bedingungen könnte die Luftzufuhr
nur zum Theile regulirt werden für einen Durchschnittsgehalt an
Schwefelwasserstoff, und Verluste in Form von schwefliger Säure oder
Schwefelwasserstoff würden beständig auftreten, müſsten controlirt werden, und
die Schwefelausbeute würde unbestimmt und unregelmäſsig sein (vgl. 1888 268 586).
Drei Jahre, von 1883 bis 1886, währten unsere Bestrebungen, diese Schwierigkeiten
zu beseitigen; als wir sie schlieſslich überwunden hatten, war der Erfolg
sicher.
Bei der Zersetzung der Sodarückstände durch Kalkofengase wird Schwefelwasserstoff
in verschiedener Menge entwickelt, je nach der Stärke des Kohlensäuregases
selbst und je nach dem Stadium der Zersetzung der Sodarückstände.
Der Procentgehalt des so erzeugten Gases an Schwefelwasserstoff schwankte von 1
Proc. bis 35 Proc. Eine erste Bedingung des Erfolges war, Kalkofengase zu
erhalten, deren Procentgehalt an Kohlensäure möglichst constant war, und die
Erfahrung, die wir während unserer Versuche nach Schaffner und Helbig gemacht hatten,
waren von groſsem Werthe.
Bei den sehr gut arbeitenden Kalköfen enthalten die ausströmenden Gase nie mehr
als 30 Proc. Kohlensäure im Durchschnitte, die übrigen 70 Proc. sind fast
vollständig Stickstoff der Luft. Dieser von der Kohlensäure untrennbare
Stickstoff ist stets, seit den Versuchen von Goſsage bis heute, das hauptsächlichste Hinderniſs gewesen für die
Verbrennung des so verdünnt erhaltenen Schwefelwasserstoffes zu schwefliger
Säure und für die Erzeugung von Schwefelsäure. Durch unsere Bemühungen,
Schwefelwasserstoff von regulärer fester Zusammensetzung zu erhalten, haben wir
schlieſslich diese Schwierigkeit überwunden und es ist gelungen, so viel von dem
begleitenden Stickstoffe zu eliminiren als nothwendig war, um die
Schwefelwasserstoffgase hinreichend zur Schwefelgewinnung durch den Claus-Ofen und zur Fabrikation von Schwefelsäure
durch einfache Verbrennung zu erhalten.
Es ist bekannt, daſs eine Mischung von Sodarückständen mit Wasser vollständig
zerlegt wird unter Bildung von kohlensaurem Kalke und Schwefelwasserstoff, wenn
durch sie Gase streichen – besonders in einer Reihe von Gefäſsen – wie sie aus
einem geschlossenen Kalkofen entwickelt werden, nur ist der so erzeugte
Schwefelwasserstoff mit so vielen und verschiedenen Mengen anderer Gase
verdünnt, daſs er nicht leicht verwerthbar ist. Bei unserer Erfindung ist der
erhaltene Schwefelwasserstoff von viel geringerer
und sehr constanter Menge anderer Gase begleitet,
so daſs er direkt zur Darstellung von schwefliger Säure und Schwefelsäure verbrannt oder
zur Gewinnung von Schwefel in dem vorhin beschriebenen Clans-Ofen vortheilhaft angewandt werden kann. Eine Mischung von
Sodarückständen mit Wasser, eine dünne Milch, von der die gröberen Theile
abgesiebt sind, wird in eine Reihe von Gefäſsen eingetragen, welche durch Röhren
verbunden und auſsen und innen mit Leitungen versehen sind; und durch alle oder
einige solcher Gefäſse werden Kalkofengase gepumpt, die fast vollständig aus
Kohlensäure und Stickstoff bestehen. Wenn diese Gase nach ihrem Eintritte in die
Gefäſse mit der Milch in Berührung kommen, wird die Kohlensäure vom freien Kalke
unter Bildung von Calciumcarbonat, vom Schwefelcalcium bei Gegenwart von Wasser
unter Bildung von Calciumcarbonat und Schwefelwasserstoff absorbirt; dieser
Schwefelwasserstoff wird vorwärts getrieben in andere Gefäſse, die mit einer
weiteren Menge Sodarückständen beschickt sind, und unter Bildung von
Calciumsulfhydrat CaS2H2 absorbirt. Bei diesem Prozesse, der als
„zweifache Absorption“ bezeichnet werden kann, enthalten die aus den
letzten Gefäſsen kommenden Gase weder Kohlensäure noch Schwefelwasserstoff oder
nur Spuren davon und können entweichen, durchstreichen jedoch bei groſser
Vorsicht noch einen mit Eisenoxyd oder Kalk gefüllten Reiniger.
Der erste durch unseren Prozeſs erreichte Vortheil ist somit die Beseitigung der
unthätigen verdünnenden Gase – hauptsächlich Stickstoff – welche entweichen
dürfen, die zurückbleibenden Gase verhältniſsmäſsig bereichert lassend. Als wir
fanden, daſs die aus dem ersten Kessel entweichenden Gase in groſser Menge
Schwefelwasserstoff enthielten, in Folge der Thatsache, daſs die Kohlensäure auf
das gebildete Calciumsulfhydrat eingewirkt hatte und daſs dann für jedes
Aequivalent Kohlensäure, welches absorbirt ist, zwei Aequivalente
Schwefelwasserstoff frei geworden waren: CO2 +
CaH2S2 +
H2O = CaCO3
+ 2H2S, schlossen wir den Ausgang des ersten
Kessels und öffneten einen anderen eines mittleren Kessels, aus welchem der
Schwefelwasserstoff in hinreichender Stärke herausströmte. Die Gase, so doppelt
reich an Schwefelwasserstoff, bereichert einmal durch die Entfernung einer
beträchtlichen Menge unwirksamen Gases und dann durch die Zerlegung des
Sulfhydrates, enthielten jetzt hinreichend Schwefelwasserstoff, um sie
vortheilhaft zu verwerthen.
Wir leiteten sie jetzt für sich fort, so lange sie hinreichend Schwefelwasserstoff
enthielten, in einen Gasbehälter, aus dem sie zur Schwefel- oder
Schwefelsäure-Gewinnung benutzt wurden. Sobald die Gase nicht mehr reich genug
an Schwefelwasserstoff waren, schlössen wir den Ausgang, und nachdem wir das
erste oder die ersten Gefäſse, in welchen die Sodarückstände vollständig zerlegt
waren, entleert und ein anderes oder andere in der Reihe mit frischer Mischung
von Sodarückständen und Wasser gefüllt, nahmen wir unsere Operationen wie zuerst
auf und so beständig fort. Nach vollständiger Zerlegung der Rückstände, so vollständig,
daſs das abfiltrirte Wasser auf Zusatz von Bleilösung weder schwarz noch dunkel
gefärbt wurde, bestand die zurückbleibende Mischung hauptsächlich aus
Calciumcarbonat in Gestalt von Schlamm, welcher zur Sodaschmelze an Stelle von
Kalkstein gebraucht werden kann. Der Werth dieses Schlammes für den
Sodaschmelzprozeſs ist beträchtlich vergröſsert durch die Gegenwart
verschiedener Salze, die in den ursprünglichen Rückständen enthalten und durch
Einwirkung der Kohlensäure in Bicarbonate übergeführt sind. Der Werth dieser so
gewonnenen Salze kann danach geschätzt werden, daſs von der Menge der jetzt in
den Alkalirückständen weggeworfenen und verlorenen Salze zwischen 2,5 und 3t auf je 100t erzeugter Soda wieder gewonnen und statt des kohlensauren Kalkes zur
Schmelze gebraucht werden können. Eine andere vortheilhafte Verwendung dürfte
dieses Kalkcarbonat in der Cementfabrikation finden, analog dem früher bei dem
Schaffner- und Helbig Verfahren gewonnenen, worauf ich in meinem Vortrage in
Liverpool 1883 bereits aufmerksam machte.
Das zurückbleibende Wasser ist, wenn es aus dem Carbonate kommt, dem Aussehen nach
zwar ziemlich schmutzig, filtrirt aber fast klar; wir haben es während langer
Zeit immer wieder gebraucht, um es mit neuen Rückständen zu mischen.“
P. Behrend.
(Fortsetzung folgt.)
Tafeln