| Titel: | Neuerungen im Metallhüttenwesen. |
| Fundstelle: | Band 275, Jahrgang 1890, S. 247 |
| Download: | XML |
Neuerungen im Metallhüttenwesen.
(Fortsetzung des Berichtes Bd. 273 S.
413.)
Mit Abbildungen auf Tafel
13.
Neuerungen im Metallhüttenwesen.
Aluminium. L. Grabau in Hannover benutzt, wie bereits
früher mitgetheilt wurde (1889 272 392), bei der
Darstellung von Aluminium durch Reduction von Fluoraluminium mittels Alkalimetalls
gekühlte Gefäſse. Zugleich wählt er die Mengenverhältnisse des Fluoraluminiums und
des Alkalimetalles derart, daſs nach der Reaction das leichtflüssige Salz (Al2Fl6, 6NaFl)
vorhanden ist. Diese Mengenverhältnisse ergeben sich aus folgender Gleichung:
2Al2Fl6 + 6Na = 2Al + Al2Fl6, 6NaFl.
Nach Feststellung dieses Mischungsverhältnisses wird das Fluoraluminium auf etwa 600°
C. vorgewärmt, bei welcher Temperatur es noch pulverförmig bleibt, aber bei
Berührung mit dem vorher geschmolzenen Alkalimetalle, auf welches es dann geschüttet
wird, sich sofort zu Aluminium und Alummiumalkalifluorid umsetzt (vgl. Curt Netto's Verfahren 1889 272 394).
Bei Ausführung des Verfahrens muſs das Reductionsgefäſs gekühlt werden, um das bei der Reduction
entstehende Al2Fl6,
6NaFl an der Innenwand des Gefäſses zum Erstarren zu bringen, zwecks Bildung eines
festen Futters, welches die Gefäſswandungen vor der Berührung mit der Schmelze und
dem geschmolzenen Metalle schützt und welches Futter weder von der Schmelze noch von
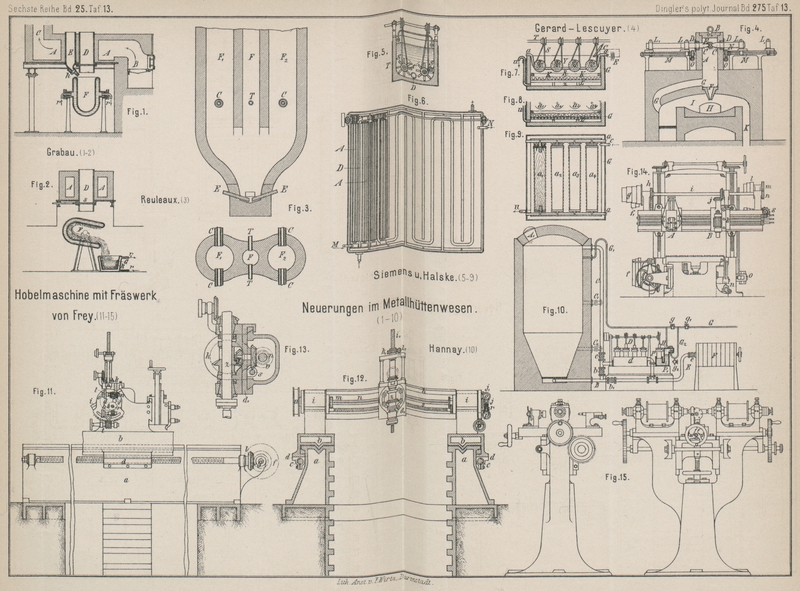
dem Aluminium zerstört werden soll. In Fig. 1 und 2 sind die für die
Erzeugung von Aluminium construirten Einrichtungen dargestellt.
Ofen A mit Feuerungsanlage B und Schornstein C dient zum Erhitzen der
mit Chamotte umkleideten eisernen Gefäſse D und E. Gefäſs D dient zum
Erhitzen des Fluoraluminiums und ist unten mit dem Schieber s verschlossen. Gefäſs E dient zum Schmelzen
des Natriums und kann durch den Hahn h entleert werden.
F ist das gekühlte Reductionsgefäſs mit
Rohrleitungen r und r1 zum Ein- und Austritte der Kühlflüssigkeit. G ist das Gefäſs, in welches die Schmelze gegossen
wird; dasselbe erhält ebenfalls durch die Rohrleitungen r und r1 die
Kühlung.
Durch Heizung auf dem Roste B werden die Retorten D und E auf Dunkelrothglut
gebracht. Darauf wird D mit so viel Fluoraluminium
gefüllt, wie es einer Beschickung entspricht. Nachdem das Fluoraluminium auf
Dunkelrothglut erwärmt ist, was man an dem anfangenden Entweichen weiſser Dämpfe
erkennt, wird die entsprechende Menge Alkalimetall in das Gefäſs E gebracht. Dasselbe schmilzt sehr rasch, wird dann
sofort, nachdem es geschmolzen ist, durch Oeffnen des Hahnes h in das Reductionsgefäſs F abgelassen. Wenn
alles Alkalimetall abgelassen ist, wird Schieber s
geöffnet, sämmtliches Fluoraluminium fällt dann mit einem Male auf das Alkalimetall
und die Reaction beginnt. Da das Fluoraluminium nicht geschmolzen, sondern
pulverförmig das Alkalimetall bedeckt, so bleibt letzteres bis zum Schlusse der
Reaction bedeckt, was bezüglich der Ausbeute von groſsem Werthe ist.
Durch die Reaction entsteht eine sehr hohe Hitze, und da die Mengenverhältnisse
zwischen Alkalimetall und Fluoraluminium so gewählt worden sind, daſs nach der
Reaction Kryolith entsteht, welcher bei Rothglut schon schmelzbar ist, so wird der
ganze Inhalt dünnflüssig, erstarrt an den gekühlten Wandungen zu einer fingerdicken,
die Wärme schlecht leitenden Kruste, welche weder von dem flüssigen Kryolith noch
von dem Aluminium angegriffen werden kann, und ermöglicht wegen der Dünnflüssigkeit
des Inhaltes das Ansammeln des Aluminiums zu einem Regulus ohne Anwendung von
Fluſsmitteln. Nach erfolgter Reaction, die bei dem oben angegebenen
Mischungsverhältnisse nur wenige Secunden dauert, und nachdem man das
Reductionsgefäſs etwas hin und her geschüttelt hat zum raschen Absetzen des
Aluminiums, wird das Gefäſs gekippt und in das gekühlte Gefäſs G (Fig. 2) entleert. Uie in
dem Gefäſse F gebildete Kryolithkruste k bleibt sitzen und der Apparat ist wieder für eine
neue Beschickung benutzbar.
Die in dem Gefäſse G erstarrte Schmelze läſst sich
leicht von dem ebenfalls erstarrten Aluminiumregulus, z.B. durch einige
Hammerschläge, trennen.
Der Patentschutz des vorbeschriebenen, durch D. R. P. Nr. 47031 vom 15. November 1887
geschützten Verfahrens bezieht sich nur auf eine Combination und lautet:
„Darstellung von Aluminium aus Fluoraluminium mittels Alkalimetalles ohne
Anwendung eines Fluſsmittels durch gleichzeitige Benutzung folgender drei
Operationen:
a) Anwendung solcher Mengen Fluoraluminiums und Alkalimetalles, daſs der Vorgang
etwa nach folgender Gleichung stattfinden kann:
2 (Al2Fl6) + 6R =
2Al + Al2Fl6,
6RFl,
wenn R das Alkalimetall bedeutet;
b) Vorwärmung des Fluoraluminiums ohne Fluſsmittel bis zu einer solchen
Temperatur (etwa 600 bis 700°), bei welcher es noch pulverförmig bleibt, aber
bei der Berührung mit dem Alkalimetalle sich sofort mit letzterem zu Aluminium
und Aluminiumalkalifluorid umsetzt, und
e) Anwendung von Gefäſsen mit gekühlten Wandungen (Fig. 1 und 2), in
welchem das geschmolzene Alkalimetall ohne Gegenwart von Fluſsmitteln behufs
Ausführung der Reaction mit dem pulverförmigen vorgewärmten Aluminiumfluorid
überschüttet wird, damit das hierbei entstehende, bei der Reactionstemperatur
feuerflüssige Aluminiumalkalifluorid ganz oder theilweise an den Gefäſswandungen
erkaltet und sich an denselben als eine schützende Kruste ansetzt, so daſs die
Gefäſse ein unangreifbares Futter erhalten.“
Durch das Zusatzpatent Nr. 49311 vom 12. September 1888 wurde das Verfahren noch
dahin abgeändert, daſs statt der Gefäſse mit gekühlten Wandungen auch kalte oder ungeheizte
Gefäſse benutzt werden können.
Ein anderes Verfahren von Grabau zur Gewinnung von
Aluminium, welches jedoch zu dem vorstehend beschriebenen Verfahren in innigster
Beziehung steht, betrifft die Verarbeitung von schwefelsaurer Thonerde auf
Aluminium, wobei dieselbe jedoch zuerst in Fluoraluminium umgewandelt wird. Der
Erfinder will einen Kreisprozeſs anwenden, bei welchem theoretisch nur
Aluminiumsulfat und Natrium und nur zu Beginn des Verfahrens natürlicher Kryolith
nothwendig ist, da der bei der Aluminiumreduction gewonnene künstliche Kryolith mit
Aluminiumsulfat in Natriumsulfat und Fluoraluminium und letzteres wieder mit Natrium
in Aluminium und künstlichen Kryolith umgewandelt wird. Ein solcher Kreisprozeſs
läſst sich durch folgende Gleichungen veranschaulichen:
1) Al2Fl6, 6NaFl + Al2(SO4)3 = 2Al2Fl6 + 3Na2SO4;
2) 2Al2Fl6 + 6Na = 2Al + Al2Fl6, 6NaFl.
Der Erfinder ist sich aber wohl bewuſst, daſs einerseits nicht die theoretische Menge
von Fluoraluminium nach Gleichung 1), andererseits nicht die theoretische Menge von
Kryolith nach Gleichung 2) gewonnen wird. Er verfährt daher folgendermaſsen:
Eine Lösung von schwefelsaurer Thonerde wird in der Wärme mit gepulvertem Fluſsspath
behandelt. Hierdurch wird der gröſsere Theil der an der Thonerde gebundenen
Schwefelsäure unter gleichzeitiger Gypsbildung durch Fluor ersetzt. Gyps und
unzersetzter Fluſsspath bleiben als ungelöster Rückstand, während eine
eigenthümliche chemische Verbindung von schwefelsaurer Thonerde und Fluoraluminium,
ein Fluorsulfat, in Lösung geht.
Der Prozeſs kann nach folgender Gleichung verlaufen:
3) Al2(SO4)3 + 2CaFl2 = Al2Fl4SO4 + 2CaSO4.
Die erhaltene Lösung wird eingedickt und mit so viel Fluoralkali bezieh. Kryolith
gemischt, daſs das Fluoralkali derselben der im Fluorsulfate enthaltenen
Schwefelsäure äquivalent ist.
Das Gemenge wird getrocknet und zwecks Bildung von Fluoraluminium geglüht, das
Product ausgelaugt und der Rückstand getrocknet. Dieser Vorgang wird durch folgende
Gleichung veranschaulicht:
4) 3Al2Fl4SO4 + Al2Fl6, 6NaFl = 4Al2Fl6 + 3Na2SO4.
Das bei diesem Prozesse erhaltene Fluoraluminium wird erhitzt und mit etwa der Hälfte
des zur theoretisch vollständigen Reduction nothwendigen Alkalimetalles, des
Natriums, reducirt, wobei neben metallischem Aluminium eine aus
Fluoraluminiumfluoralkali bestehende Schmelze (Gleichung 2) erzeugt wird. Der
hierbei entstehende künstliche Kryolith findet für den Prozeſs nach Gleichung 4)
wieder Verwendung, so daſs also ein Ringprozeſs entsteht, durch welchen es
ermöglicht wird, in dem Verfahren, ausgenommen bei der Inbetriebsetzung, nur selbst
gewonnenen Kryolith, und als Fluormaterial das billigste Material, den Fluſsspath,
auſser dem zur Reduction nothwendigen Alkalimetalle zu verwenden.
Ein anderes Verfahren zur Gewinnung von Aluminium aus den Doppelfluoriden desselben
mit Barium, Strontium, Calcium, Magnesium und Zink ist dem Alexander Feldmann in Linden vor Hannover unter Nr. 49915, gültig vom 24.
Juli 1887, in Deutschland patentirt worden. Das Verfahren bezweckt, bei der
Benutzung des Fluorids sämmtliches Aluminium aus der Schmelze abzuscheiden, was
jedoch bei Anwendung von Fluoraluminiumfluoralkali unter Zusatz von Chloralkalien
nicht möglich sein soll, da der Rest des Aluminiums in Folge der groſsen Affinität
des Fluoraluminiums zu den Alkalifluoriden gebunden bleibt.
Eine vollständige Trennung des Aluminiums von dessen Fluorid soll sich jedoch
erzielen lassen, wenn man die Verbindung des letzteren mit den Fluoriden der
alkalischen Erden oder mit Fluorzink zu dem Verfahren anwendet und dabei der
Schmelze Erdalkalichloride (am besten Strontiumchlorid) zusetzt, welche dazu dienen,
unter Abgabe von Chlor das vom Aluminium abgeschiedene Fluor aufzunehmen, sowie die Schmelze
leichtflüssiger zu machen. Die besagten Doppelfluoride gewähren auſser dem obigen
noch den Vortheil, daſs sie sich durch Chloraluminium oder durch schwefelsaure
Thonerde regeneriren lassen.
Als Beispiel kann die elektrolytische Behandlung der Doppel Verbindung
Aluminiumstrontiumfluorid dienen. Wird diese unter Zusatz von Strontiumchlorid im
Ueberschusse geschmolzen und der Einwirkung des elektrischen Stromes ausgesetzt, so
scheidet sich nach Ansicht des Erfinders Aluminium vollständig aus; ein
entsprechender Theil des Chlores (welches in geeigneter Weise abgeführt werden muſs)
entweicht, und es verbleiben als Rückstand Strontiumfluorid und
Strontiumchlorid.
Dieser Vorgang erfolgt nach der Gleichung:
(Al2F6 + 2SrF2) + 3SrCl2 + xSrCl2 = 2Al +
6Cl + (5SrF2 + xSrCl2).
Nach Entfernung des ausgeschiedenen Aluminiums wird die rückständige Masse behufs
deren Regeneration mit einer wässerigen Lösung von Aluminiumchlorid im Verhältnisse
von 1 Aeq. desselben zu 5 Aeq. Strontiumfluorid versetzt, gekocht und eingedampft
und dadurch die ursprüngliche Schmelze wieder hergestellt, wie sich aus folgender
Gleichung ergibt:
5SrF2 + xSrCl2 + Al2Cl6 = Al2F6 + 2SrF2 + 3SrCl2 + xSrCl2.
In gleicher Weise wie das Aluminiumstrontiumfluorid verhalten sich bezüglich der
elektrolytischen Behandlung und der Regeneration die Doppelfluoride des Aluminiums
mit Barium, Calcium und Magnesium, nicht aber das Aluminiumzinkfluorid. Aus
sämmtlichen genannten Doppelfluoriden, einschlieſslich des letzteren, kann aber auch
durch geeignete Metalle das Aluminium gewonnen werden; doch ist bei Anwendung von
Alkalimetallen ein solches Quantum (3 Aeq.) eines Erdalkalichlorides, am besten
Chlorstrontium, zuzusetzen, daſs die Bildung von Fluoraluminiumfluoralkali
ausgeschlossen ist. Zur Zersetzung der Fluoride von Aluminiumstrontium,
Aluminiummagnesium, Aluminiumbarium und Aluminiumcalcium eignen sich sämmtliche
Alkalimetalle, während durch Magnesium und Zink das Aluminium sich nur aus
Aluminiummagnesiumfluorid und Aluminiumzinkfluorid abscheiden läſst.
Bei der Regeneration der unter Anwendung von Alkalimetall entfallenen Rückstände muſs
das in diesen enthaltene Alkalichlorid vorher ausgewaschen werden. Die Regeneration
erfolgt dann analog dem beim Aluminiumstrontiumfluorid angegebenen Beispiele, und
wird dann jedesmal durch Anwendung von wässerigem Aluminiumchlorid das ursprünglich
angewendete Doppelsalz zurückgebildet. Die bei der Reduction mittels Magnesiums und
Zinks sich ergebenden Rückstände, welche Magnesiumfluorid bezieh. Zinkfluorid
enthalten, werden nach dem Auswaschen des Erdalkalichlorides (Chlorstrontium) mit 1
Aeq. einer wässerigen Lösung von schwefelsaurer Thonerde gekocht und eingedampft.
Darauf wird das gebildete Magnesium- oder Zinksulfat sorgg ausgewaschen und dem so
erzielten Rückstande wieder Erdalkalichlorid (Chlorstrontium) zugesetzt.
Die Patentansprüche lauten:
„1) Das Verfahren zur Darstellung von Aluminium, bestehend in der
elektrolytischen Zersetzung der geschmolzenen Verbindungen von Aluminiumfluorid
mit den Fluoriden von Barium, Strontium, Calcium und Magnesium, oder in der
chemischen Zersetzung der Verbindungen des Aluminiumfluorids mit den Fluoriden
von Barium, Strontium, Calcium, Magnesium und Zink durch geeignete Metalle, in
beiden Fällen unter Hinzufügung eines Erdalkalichlorides zur geschmolzenen
Masse.
2) Die Regeneration der bei dem in Anspruch 1) charakterisirten Verfahren
entstehenden Rückstände durch Behandlung mit Aluminiumchlorid oder
Aluminiumsulfat, geeignetenfalls nach Auswaschen des in den Rückständen
enthaltenen löslichen Salzes.“
Louis Reuleaux in Liege macht den Vorschlag, diejenigen
Materialien, welche durch die galvanische Wärme zu schmelzen oder durch Elektrolyse
zu zersetzen sind, vor ihrer Ankunft in dem elektrischen Schmelzherde auf eine
möglichst hohe Temperatur zu bringen.
Zu diesem Zwecke wird ein Ofen mit drei Schächten FF1
F2 (Fig. 3) verwendet. In den
Mittelschacht bringt man Koks oder Holzkohle, während die seitlichen Schächte mit
Erzen und Fluſsmitteln beschickt werden.
Der Mittelschacht F ist mit Düsen T und die seitwärts befindlichen Schächte F1 und F2 sind mit
Knallgasdüsen C versehen. Diese Düsen sind genügend von
den Elektroden E und ihrem Wirkungskreise entfernt
angeordnet, damit der Wind u.s.w., welchen sie einführen, die Wirkung der Elektroden
nicht beeinträchtigt.
Durch die Düsen T wird atmosphärische Luft und durch die
Knallgasdüsen C Steinkohlengas oder Wasserstoffgas oder
ein flüssiger Brennstoff eingeblasen. Die durch die Düse T eingeblasene atmosphärische Luft verbrennt einen Theil des Koks oder der
Holzkohle, welche sich im Mittelschachte befindet, und erhitzt auf diese Weise den
anderen Theil der Kohle oder des Koks.
Das durch die Düsen C eingeblasene Gas heizt die zu
zersetzenden Materialien (Erze und Fluſsmittel), welche sich in den seitwärts
gelegenen Schächten befinden.
Nach unten zu vereinigen sich die drei Schächte zu einem einzigen und schlieſsen sich
an einen der schon bekannten elektrischen Reductionsherde an.
So wie die Materialien in dem Schmelzherde reducirt werden und die Erzeugnisse aus
demselben in die freie Luft flieſsen, werden dieselben in dem Schmelzherde durch
neue Materialien ersetzt, welche, anstatt wie gegenwärtig kalt, stark erhitzt in
denselben kommen. Da der durch einen Brennstoff erzeugte Wärmeertrag viel weniger
kostspielig ist als
derselbe, welcher durch Elektricität erzeugt wird, so werden dadurch die
Selbstkosten der erzeugten Metalle wesentlich billiger.
Für die Erhaltung der Wände des Ofens und besonders derjenigen des Mittelschachtes
kühlt man dieselben ab, wenn es nöthig ist, sei es durch eine Bewässerung oder durch
in den Wänden angebrachte Röhren, in welchen man flieſsendes Wasser zum Umlaufe
bringt. (D. R. P. Nr. 49207 vom 27. Januar 1889.)
Während nach den bisher bekannt gewordenen Verfahren zur Gewinnung von Aluminium und
dessen Legirungen eine feuerflüssige Schmelze oder eine wässerige Lösung als
Elektrolyt verwendet worden ist, will Gérard-Lescuyer
in Courbevoie nach dem D. R. P. Nr. 48040 vom 6. Januar 1889 den Elektrolyten
gänzlich umgehen. Er bildet aus den Rohmaterialien und Kohle Stangen oder Barren und
verwendet dieselben als Elektroden bei der Erzeugung des Volta-Bogens.
Diese Elektroden sind in einem dicht geschlossenen Raume angebracht, welcher über
einem Flammofen so angeordnet ist, daſs das aus dem Barren freiwerdende Metall in
den letzteren tropfen kann, um dort raffinirt zu werden.
Die beispielsweise zur Darstellung der Aluminiumbronze zu benutzenden Stoffe sind
metallisches Kupfer, Thonerde und Kohle. Dieselben werden fein gepulvert und mit
einem passenden Bindemittel, wie Theer, Zuckersyrup u. dgl. innig zu einer homogenen
Masse zusammengemischt. Aus dieser Mischung werden mittels hydraulischer Pressen
Stäbe, Stangen oder Barren hergestellt.
Der zur Ausführung des Verfahrens dienende Ofen setzt sich zusammen aus dem mittels
Deckels B (Fig. 4) dicht
abgeschlossenen elektrischen Ofen A, dessen Sohle durch
den etwas conischen Kanal F mit dem Flammofen I communicirt, um das freiwerdende Metall in letzteren
abtropfen zu lassen, ein seitlicher Kanal G führt das
in A sich erzeugende Kohlenoxydgas nach dem Flammofen,
in welchem es mit der durch K aus dem Wärmeregenerator
zugeführten heiſsen Luft zusammentrifft. Die Barren C
werden unter Führung in L1 vom Schlitten L getragen, die mittels der
durch Schnecke und Rad O N angetriebenen Schrauben M gegen den Ofen A
vorgeschoben werden können, in welchem die Barren mit ihren vorderen Enden durch die
mit Asbestdichtung versehenen Oeffnungen D eindringen.
Die Vorgänge im Ofen A können mittels der Schaulinse
E beobachtet werden.
Sobald sich durch Anwendung einer kräftigen Dynamo zwischen den Elektroden der
Flammen bogen bildet, wird angeblich die Thonerde in Folge der ungeheuren
Wärmeentwickelung durch die Kohle reducirt. Das freigewordene Aluminium verbindet
sich mit dem Kupfer und die entstandene Aluminiumbronze fällt in Tropfen nach der
Sohle und durch F in den Flammofen. Das in Folge der
Reduction sich bildende Kohlenoxydgas tritt nach dem Flammofen durch den Kanal G, an dessen Ausmündung es sich durch Zusammentreffen mit der durch K aus dem Wärmeregenerator zuströmenden heiſsen Luft
entzündet. Die Zahl der Elektroden C richtet sich nach
dem Raume und der Stärke des Stromes. Eine Arbeitsöffnung H gestattet, die auf der Sohle des Flammofens sich ansammelnde Metallmasse
zur Trennung von der Schlacke mit Kalk oder anderen Fluſsmitteln zu versetzen. Die
Legirung wird von Zeit zu Zeit durch einen Abstich entleert. Das gleiche Resultat
soll sich auch erreichen lassen, wenn man unter jedem Elektrodenpaare zum Auffangen
des Metalles einen Tiegel anordnet.
Um an Aluminium reiche Bronzen darzustellen, nimmt man zur Bereitung der Barrenmasse
die bei einer vorhergehenden Operation erhaltene Legirung in Gestalt von Pulver.
Die Reduction hat immerhin eine gewisse Aehnlichkeit mit dem Cowles'schen Verfahren, nach welchem bekanntlich zunächst Thonerde in
Mischung mit Kohle durch den elektrischen Strom derart geschmolzen wird, wie William Siemens seiner Zeit Stahl im Flammenbogen zur
Verflüssigung brachte. Die Abscheidung des Aluminiums erfolgt dann wahrscheinlich
durch einen chemischen Prozeſs, nämlich durch Reduction der Thonerde mittels Kohle,
indem die fehlende Wärme durch den Strom geliefert wird. Aus diesem Grunde ist es
auch nicht nothwendig, daſs die Abscheidung des Aluminiums gemäſs dem Faraday'schen Gesetze erfolgt, da ein eigentlich
elektrolytisches Verfahren wahrscheinlich nicht vorliegt. Die Menge des Aluminiums
kann unter Umständen sogar weit gröſser sein, als wenn ein elektrolytisches
Verfahren vorläge.
Fast ganz übereinstimmend mit dem in der Patentschrift Nr. 48040 beschriebenen
Verfahren ist dasjenige des Dr. O. Knöfler in Berlin
und des Dr. H. Ledderboge in Oranienburg, welches ebenfalls unter Patentschutz gestellt ist (D. R. P. Nr. 49329 vom 6. Februar
1889).
Der Patentanspruch des letzteren Patentes lautet: „Die Reduction von Aluminium und
Magnesium aus den Oxyden durch Erhitzung eines in Stabform gebrachten Gemisches
der Oxyde mit Kohle, welches nach Art der Kohlen in Bogenlichtlampen in einen
elektrischen Stromkreis eingeschaltet wird, während die Einwirkung der sich
bildenden Kohlenoxyde auf das reducirte Metall durch einen Strom eines
indifferenten Gases oder durch einen luftleeren Raum verhindert wird“.
Die Vorschläge von Henderson und Lontin zur Aluminiumgewinnung stimmen darin überein, daſs beide statt der
theueren Halogenverbindungen das billige Oxyd des Aluminiums bei der Elektrolyse
verwenden wollen. Henderson (Englisches Patent Nr. 7426
vom Jahre 1887) wendet eine geschmolzene Mischung von Thonerde und Kryolith an; Lontin (Französisches Patent Nr. 158182 vom 23. Oktober
1883) schmilzt behufs Gewinnung der Erdmetalle die Oxyde derselben mit Soda,
Potasche, Borax,
Cyankalium oder irgend einem anderen Fluſsmittel zusammen. Er kann also
beispielsweise für Aluminiumgewinnung eine Schmelze aus Thonerde und Fluſsspath der
Elektrolyse unterwerfen, da Fluſsspath offenbar eines der gewöhnlichsten Fluſsmittel
ist.
Mobery, Tone und Keep haben den ausgezeichneten Einfluſs
des Aluminiums auf Eisen in zahlreichen Versuchen festgestellt, bei welchen sie
Ferroaluminium von der Cowles-Compagnie benutzten (Bulletin de la société d'encouragement, 1889 S. 277,
vgl. auch Mitisguſs in D. p.
J. 1888 267 391 und 1889 272 398).
Prof. Tetmeyer in Zürich hat im Auftrage der Aluminium-Industrie-Actiengesellschaft in Neuhausen
eine groſse Reihe von Versuchen angestellt über Festigkeit und Dehnbarkeit von
Aluminiumbronze und Aluminiummessing, welches aus den Werken zu Neuhausen stammte.
Die Resultate dieser Untersuchungen finden sich in folgender Tabelle
zusammengestellt:
Aluminiumbronze
Aluminiummessing
Aluminium-gehaltin Procenten
Zugfestigkeitfür 1 qmm
Dehnungin Procenten
Aluminium-gehaltin Procenten
Zugfestigkeitfür 1 qmm
Dehnungin Procenten
11,5
80k
½
4,5
69k
6,5
11
68
1
3
60
7,5
10
64
11
2,5
52
20
9,5
62
19
2
48
30
9
57,5
32
1,5
45
39
8,5
50
52,5
1
40
50
5,5
44
64
Aus dieser Tabelle geht hervor, daſs ein Aluminiummessing von 2,5 Proc. Aluminium
eine gröſsere Festigkeit besitzt als Fluſsstahl; die Festigkeit des Guſsstahles für
Geschützrohre fällt erst mit dem Aluminiummessing von 2,8 Proc. Aluminiumgehalt
zusammen. Aluminiumbronze mit beispielsweise 9,8 Proc. Aluminium übertrifft an
Festigkeit um etwa 14 Proc. den Guſsstahl für Geschützrohre.
Hinsichtlich des Netto'schen Verfahrens der
Aluminiumgewinnung (1889 272 394) ist zu bemerken, daſs
sich in England die Aliance Aluminium Comp. gebildet
hat, um dasselbe auszubeuten, sowie das Verfahren von Webster von der Crown Metall Comp. und
dasjenige von Castner von der Birmingham Aluminium Comp. ausgeübt wird. Das Héroult'sche Verfahren der Erzeugung von Bronze (Englisches Patent Nr.
16853 vom Jahre 1887) wird, wie verlautet, in der Schweiz ausgeführt.
Ein elektrolytisches Verfahren von Minet wurde auf der
jüngsten Pariser Ausstellung demonstrirt. Minet benutzt
Fluoraluminiumfluornatrium als Elektrolyt und regenerirt die Schmelze durch Bauxit,
welches sich mit dem ausgeschiedenen Fluor sofort zum Fluorid der Thonerde verbinden
soll.
Um 100 Pfund Aluminium zu erzeugen sind 150 Pfund Aluminiumfluorid oder 200 Pfund
Al2O3
erforderlich. Zudem setzt man zu dem Bade 100 Pfund NaCl, um sein Niveau constant zu
halten. Theoretisch würden 84,4 Gew.-Th. Aluminiumfluorid zur Gewinnung von 27,4 Th.
Aluminium aufgewendet werden müssen. Daſs weniger gebraucht wird, beruht auf dem
Zusätze von Bauxit während der Elektrolyse. Das Elektrolysirgefäſs wird aus
Guſseisen, die Elektroden werden bei der Darstellung von reinem Aluminium aus
comprimirter Kohle hergestellt; soll Aluminiumbronze erzeugt werden, so ist die
Kathode aus Kupfer gemacht, wohingegen sie aus Eisen besteht, wenn Ferroaluminium
erzeugt werden soll. Der Niederschlag fällt in einen Graphitkübel. Um das
guſseiserne Gefäſs vor Fluor zu schützen, schaltet Minet dasselbe in den Nebenschluſs zu der Kathode, und zwar durch einen
Widerstand, welcher nur 10 Proc. des Stromes durchläſst. Das Aluminium setzt sich
dann theilweise auch an den Gefäſswänden ab und verhütet den weiteren Contact
desselben mit dem Fluor, was sehr wesentlich ist, wenn auch etwas Aluminium verloren
geht. Ein Eisenbad halt ungefähr 13 Tage; in 12 Stunden kann man einen sogen. Ingot
erzeugen. Aus einem Bade von 13 Cubikfuſs Inhalt kann man bei 1000 Ampère 8¾ Pfund
reines Metall erhalten, während die Production von unreinem Metall bis zu 13 Pfund
beträgt.
Das vorstehend beschriebene Verfahren ist bereits seit November 1888 bei Bernard Frères in Creil in Ausübung und werden dort
täglich 33 bis 44 Pfund Aluminium erzeugt. Der Verkaufspreis beträgt gegenwärtig 40
Schilling das Pfund. Aluminium mit 4 bis 5 Proc. Eisen und 5 Proc. anderer
Verunreinigungen kostet 20 Schilling. Ingots von 2,2 bis 220 Pfund, nach vorstehend
beschriebenem Verfahren dargestellt, waren auf der Pariser Ausstellung zu sehen
(vgl. auch Moniteur industriel, 1889 S. 396).
Otto Vogel bringt in der Oesterreichischen Zeitschrift für Berg- und Hüttenwesen, 1889 S. 394 bis
397, S. 408 bis 410 und S. 417 und 418, „Bemerkungen zur Aluminiumfrage“. In
diesem Aufsatze, welcher im Wesentlichen die historische Entwickelung der
Aluminiumfabrikation beleuchtet, sind unter anderen auch die nachstehenden
Mittheilungen enthalten.
Korund wird in gröſseren Massen in den Ausläufern des Alleghanigebirges in
Nord-Georgien gewonnen, welches Vorkommen im J. 1869 bereits von W. P. Thomson entdeckt wurde. Seit dieser Zeit wurde
daselbst Korund in Serpentin an etwa 30 Stellen gefunden. Der Verkaufspreis beträgt
gegenwärtig 10 Dollar die Tonne (vgl. auch Journal of Ute
Society of Chemical Industrie 1886, April).
Für Bauxit, nächst dem Korund und dem Kryolith das wichtigste Aluminiummaterial,
werden neben den verschiedenen alpinen Vorkommen noch folgende Fundorte erwähnt:
Departements Var und Bouches du Rhône, l'Hérault und l'Ariège in Frankreich, ferner Irish
Hill Straid und Glenravel in Irland, Hadamar und Mühlbach in Hessen, ferner
Klein-Steinheim, Langsdorf und endlich ein Vorkommen in Französisch-Guiana.
Der Werth des Bauxits läſst sich nicht nach dem bloſsen Augenscheine beurtheilen, da
beispielsweise ein Bauxit, der 62,10 Proc. Al2O3, 6,11 Proc. Fe2O3, 5,06 Proc. SiO2 und 28,83 Proc. H2O enthielt, ein dunkleres und unreineres Aussehen hatte als ein Stück von
Wochein, welches nur 29,8 Proc. Al2O3 enthielt.
In der nachstehenden Tabelle über Bauxit-Analysen sind nur die Hauptbestandtheile
angegeben. In geringen Mengen finden sich fast durchgehends noch CaO, MgO, SO3, P2O5, TiO2, Va2O3, Alkalien und
Spuren von Mangan.
Bauxit-Analysen:
Thonerde
Eisenoxyd
Kieselsäure
Glühverlust
Wochein in Krain (gebrannt)
82,48
5,60
9,75
–
„
63,16
23,55
4,15
8,34
„
72,87
13,49
4,25
8,50
„
29,80
3,67
44,76
13,86
Feistritz
64,25
2,40
6,29
25,74
„
64,60
2,00
7,50
24,70
„
54,10
10,40
12,00
21,90
„
44,40
30,30
15,00
9,70
Pitten (N.-Oest.)
53,00
24,20
7,50
13,10
„ „
44,10
37,20
4,70
12,00
Wöllersdorf (N.-Oest.)
49,90
29,58
7,40
12,43
Galizien
76,89
4,11
8,11
7,08
Mühlbach (Hessen)
32,46
38,04
6,68
19,90
„ „
45,77
18,97
6,41
27,61
„ „
55,61
7,17
4,41
32,33
„ „
57,62
4,24
7,00
26,99
Klein-Steinheim
56,02
6,19
10,97
26,42
Gieſsen
60,10
14,70
3,00
24,00
Wetterau
51,86
15,14
5,10
27,90
Vogelsberg
42,60
2,90
29,20
25,00
Langsdorf
50,85
14,36
5,14
28,38
„
49,02
12,90
10,27
25,91
Baux
75,00
12,00
1,00
12,00
„
60,00
25,00
3,00
12,00
Irland
52,94
2,58
4,82
30,94
„
48,12
2,36
7,95
40,33
„
43,44
2,11
15,05
35,70
„
61,89
1,96
6,01
27,82
„
73,00
4,26
2,15
18,66
Aus der nachstehenden Tabelle ist zu entnehmen, daſs hinsichtlich der Reinheit des
Handelsaluminiums noch viel zu wünschen übrig bleibt. Während die älteren
Erzeugnisse noch 10 bis 15 Proc. Verunreinigungen ausweisen, sollen bei Curt Netto und L. Grabau
die Verunreinigungen (Fe, Si, Cu, Zn, Pb, Na) auf 1 bis 1,5 Proc. hinabsinken.
Aluminium-Analysen:
Al
Si
Fe
Cu
Pb
Na
Untersucher:
88,350
2,87
2,40
6,38
–
–
Salrêtat.
88,500
2,50
2,50
6,50
–
–
„
92,000
0,45
7,55
–
–
–
„
92,500
0,70
6,80
–
–
–
Dumas.
92,969
2,149
4,882
–
–
Spur
Salvêtat.
94,700
3,70
1,60
–
–
–
Kraut.
96,160
0,47
3,37
–
–
–
Dumas.
96,253
0,454
3,293
–
–
Spur
Mallet.
96,890
1,270
1,840
Spur
–
–
„
97,200
0,25
2,40
–
Spur
Spur
Sauerwein.
97,400
1,00
1,30
0,10
0,20
–
Hampe.
97,41
0,65
1,94
–
–
–
Richards.
97,57
0,56
1,87
–
–
–
„
97,600
0,40
1,40
0,40
0,20
–
Hampe.
97,680
0,12
2,20
–
–
–
Kraut.
97,75
0,55
1,70
–
–
–
Richards.
98,000
0,45
1,55
–
–
–
Mallet.
98,290
0,04
1,67
–
–
–
Kraut.
Rammelsberg (vgl. auch D. p.
J. 1869 191 58) kommt wie Deville zu dem Schlusse, daſs sich das Silicium im
Aluminium im Allgemeinen so verhält, wie der Kohlenstoff im Roheisen, d.h. daſs ein
Theil chemisch gebunden, ein anderer Theil mechanisch beigemengt sei.
Dumas hat durch Untersuchungen nachgewiesen (Scient. Amer. Suppl. 7. August 1880), daſs bei dem
Erhitzen des Aluminiums im luftverdünnten Raume bedeutende Mengen von Gas (CO2, H, CO, N, O) entweichen.
Nach F. Fischer ist elektrolytisch hergestelltes
Aluminium noch nicht im Handel, weil anscheinend die elektrolytische Herstellung
dieses Metalles wegen praktischer Schwierigkeiten überhaupt nicht vortheilhaft ist.
Thatsächlich sind die, welche sich anhaltend und eingehend mit dieser Frage
beschäftigt haben, zum Natriumverfahren zurückgekehrt, nur daſs statt des
Chloraluminiums jetzt Fluoraluminium vorgezogen wird (Zeitschrift für angewandte Chemie, 1. August 1888).
Nach A. Watt ist die elektrolytische Herstellung von
Aluminium überhaupt ausgeschlossen. Wie er in der London
Electrical Rev., Juli 1887, mittheilt, versuchte er saure und alkalische
Lösungen, Cyanverbindungen u. dgl., sowie auch geschmolzene Salze zu zerlegen, doch
ohne jeden Erfolg. Zu ähnlichen Resultaten gelangten auch die Herren C. Winkler und Sprague.
Bezüglich der Cowles'schen Aluminiumdarstellungsmethode
stellt F. Fischer folgende Berechnung an (Zeitschrift des Vereins deutscher Ingenieure, 1889 S.
14).
Die Zersetzung
Al2O3 + 3C = Al2 + 3CO
(– 391600 + 85000= – 305800)
erfordert für 1k Aluminium
nur 305800 : 55 = 5560 W.-E., während von der Maschine 635 × 50 = 31750 W.-E.
geliefert werden müssen.
Der elektrische Kraftaufwand für 1k Aluminium soll
50 Stunden-Pferd betragen. Werden diese 50 Stunden-Pferd durch eine Dampfmaschine
geliefert, so sind mindestens 75k Kohlen,
entsprechend etwa 560000 W.E., erforderlich. Wir hätten somit nur 1 Proc. der
theoretischen Leistung, und eben diese verhältniſsmäſsig geringe Leistung des
elektrischen Stromes macht es erklärlich, daſs man neuerdings wieder eifriger die
Herstellung des Aluminiums auf chemischem Wege versucht.
In ähnlicher Weise berechnet Fischer, daſs die Angabe,
die Neuhauser Hütte sei im Stande, täglich 300k
Aluminium zu liefern, ziemlich übertrieben ist, da ein Strom von 100 Ampère in der
Secunde nur 10mg Aluminium liefern kann, somit
12000 Ampère in der Minute 72g, d.h. in 24 Stunden
100k. Thatsächlich dürfte die Ausbeute aber
wohl noch etwas geringer sein (Zeitschrift für angewandte
Chemie, 1889 135).
Nach Dr. Kosmann (Stahl u.
Eisen, 1889 S. 19) sollen in Hemelingen bei Bremen 1000k Aluminium und mehr in wenigen Wochen geliefert
werden können. Das Werk arbeitet nicht mehr nach dem Patent Grätzel, sondern nach einem Verfahren des Direktors Saarburger.
R. Fallt und A. Schaag in Berlin stellen Aluminiumlegirungen durch galvanischen Niederschlag her (D. R. P. Nr.
48078 vom 22. August 1888). Sie benutzen ein alkalisches Bad, welches organische,
nichtflüchtige Säuren (Weinsäure, Citronensäure) enthält. Dieses wird durch
metallisches Aluminium äuſserst concentrirt gemacht; alsdann wird das betreffende
Legirungsmetall (Kupfer, Gold, Silber, Zinn, Zink) entweder durch den elektrischen
Strom oder direkt als Cyanverbindung dem Bade einverleibt, und schlieſslich wird das
so beschriebene Bad durch den Zusatz eines Alkalinitrats oder Phosphats
leitungsfähiger gemacht. Auf 100l Lösung wird 1k des Nitrates oder Phosphates angewendet.
Die Anode, dasjenige Metall enthaltend, welches neben dem Aluminium in den
galvanischen Niederschlag eingehen soll, wird von dem Bade durch eine poröse
Scheidewand oder Zelle getrennt.
Richard Falke in Berlin empfiehlt für den galvanischen
Niederschlag von aluminiumhaltigem Zink in oder ohne Verbindung mit Zinn die
folgenden Bäder:
1) Eine erhitzte Lösung von Aluminiumchlorid wird unter beständiger Erneuerung des
verdampfenden Wassers mit metallischem Zink gesättigt, welcher Lösung man auch noch
Zinkchlorid zusetzen kann. Hiernach kann man auch auf 1k Aluminiumchlorid etwa 50g Zinnchlorid
zu der soeben erhaltenen Flüssigkeit zusetzen und die Lösung noch etwa eine halbe
Stunde im Sieden erhalten. Nach dem Erkalten können diese Lösungen dann benutzt
werden.
2) Eine erhitzte Lösung von Aluminiumchlorid wird wie oben, aber mit metallischem
Zinn anstatt Zink gesättigt. Hiernach wird derselben auf 1k Aluminiumchlorid 1k Zinkchlorid hinzugesetzt, und nach einhalbstündigem Aufkochen und
darauffolgendem Erkalten ist dieselbe gebrauchsfertig.
3) Eine erhitzte Lösung von Aluminiumchlorid wird mit metallischem Magnesium oder
Aluminium gesättigt. Hiernach wird derselben auf 1k Aluminiumchlorid 1k Zinkchlorid
zugesetzt, und sobald letzteres gelöst ist, werden auf 1k Aluminiumchlorid noch etwa 50g
Zinnchlorid hinzugefügt. Nach etwa einhalbstündigem Aufkochen und darauffolgendem
Erkalten kann die Lösung benutzt werden.
Für diese soeben beschriebenen Bäder verwendet man zweckmäſsig eine Anode aus Zink
oder eine aus 1 Theil Zink und 2 Theilen Zinn.
4) Zur Erzeugung eines galvanischen Niederschlages von aluminiumhaltigem Zink kann
man sich auch einer in erhitztem Zustande mit metallischem Magnesium gesättigten
Aluminiumsulfatlösung bedienen. Zu einer solchen setzt man alsdann auf 1k Aluminiumsulfat 1k Zinkchlorid zu und benutzt sie unter Anwendung einer Zinkanode für den
galvanischen Niederschlag nach etwa einhalbstündigem Aufkochen und darauf folgendem
Erkalten.
Der hiermit erzeugte Niederschlag besteht wegen seines Gehaltes an Aluminium aus
hartem, bronzeähnlichem Kupfer oder aus hartem, politurfähigem Zinn oder zähem,
weiſsem Nickel (D. R. P. Nr. 47457, vom 4. Dezember 1887).
Kupfer und Edelmetalle. Bekanntlich wendet die Firma Siemens und Halske in Berlin bei der elektrolytischen
Gewinnung von Kupfer und Zink nach dem Patente Nr. 42243 (D.
p. J. 1888, 269; 364) eine Lösung von
Kupfersulfat und Ferrosulfat als Elektrolyt an. Derselbe durchläuft zuerst alle
Kathodenzellen hinter einander, wobei der Strom einen groſsen Theil des
Kupfersulfats zerlegt und das Kupfer an den Kathodenblechen niedergeschlagen wird.
Hierauf durchläuft der Elektrolyt alle Anodenabtheilungen nach einander, wobei durch
die Wirkung des Stromes das Eisenoxydul in Eisenoxyd verwandelt wird.
Nunmehr tritt die elektrolytische Flüssigkeit in Auslaugebassins, in welchen sie aus
geschwefelten Kupfererzen Kupfer aufnimmt und das Eisenoxyd sich wieder zu Oxydul
reducirt. In dem Zusatzpatent Nr. 48959 vom 3. Januar 1889 werden Einrichtungen zur
Lösung des Kupfers angegeben. Auch die Zersetzungszellen erhalten eine eigenartige
Einrichtung.
Zum Lösen des Kupfers dienen lange Rinnen aus Holz oder anderem passenden Materiale.
Dieselben sind der ganzen Länge nach mit gegen einander rotirenden Flügelwalzen
versehen. Fig.
5 zeigt eine Lösungszelle im Querschnitt, während die Fig. 6 einen Grundriſs des
ganzen Rinnensystems darstellt. Die hölzernen Wände T
sind mit Bleiblech auſserhalb umkleidet. Die mit Schaufeln S versehenen Walzen A drehen sich gegen einander mittels
gekreuzter wasserfester Schnüre. Ein kupfernes Heizrohr D durchläuft sämmtliche Abtheilungen der Rinne und ermöglicht die
Temperatur auf einer gewissen Höhe zu halten.
In Fig. 7, 8 und 9 ist eine
Zersetzungszelle dargestellt. Ein flaches, aus Holz mit äuſseren Bleiblechbezügen
oder aus anderem passenden Materiale hergestelltes Gefäſs G ist mit einem falschen, durchlöcherten Boden L versehen, auf welchem die Anode K sich
ausbreitet. Dieselbe kann aus passend gelagerten und leitend verbundenen Platten aus
Retortenkohle bestehen oder aus durchlöcherten Bleiplatten, welche mit Retortenkohle
in kleineren Stücken bedeckt sind, oder endlich aus einer stark gewellten Bleiplatte
mit Löchern zum Abfluſs der Flüssigkeit. Ueber die so gebildete und mit isolirten
Zuleitungen versehene wagerechte Anode wird eine Filterschicht R angeordnet, welche den Zweck hat, Strömungen der die
Anode berührenden und bedeckenden Flüssigkeit zu verhindern. Dieses Filter kann aus
Filz oder einem anderen organischen oder unorganischen Stoff bestehen. Als Kathoden
dienen die Mantelflächen von Cylindern a1, a2... a4, welche von
dem Elektrolyten ganz bedeckt sind und durch wasserfeste Schnüre continuirlich
langsam gedreht werden. Diese Walzen können aus einem Holzkern bestehen, der mit
Wachs, Kitt oder dergleichen überzogen und dann mit einem leitenden Ueberzug
bekleidet ist, welch letzterem der Strom durch die kupfernen Walzenzapfen in
passender Weise zugeführt wird.
Die regenerirte elektrolytische Flüssigkeit, aus Kupfer- und Ferrosulfatlösung
bestehend, wird in continuirlichem, vielfach verzweigtem Strome der die Walzen
bedeckenden Flüssigkeit zugeführt. Die Drehung der Walzen bewirkt die fortlaufende
Mischung der Gesammtflüssigkeit bis zu dem die Anode bedeckenden Filter. Da durch
das Rohr U aus dem Raum unter dem doppelten Boden immer
ebenso viel Flüssigkeit ab-, wie bei C oben zuflieſst,
so findet ein stetiger langsamer Strom des Elektrolyten durch das Filter zur Anode
hin statt. An diese wird das Eisenoxydul des Ferrosulfats durch den frei werdenden
Sauerstoff zu Oxyd weiter oxydirt, wobei die oxydirten Theile des erhöhten
specifischen Gewichts wegen zu Boden fallen und zunächst fortgefürt werden, so daſs
bei richtiger Regulirung des Zuflusses, der Stromstärke und des Gehalts der Lösung
an Kupfer und Eisen das Resultat des Prozesses darin besteht, daſs der Elektrolyt im
oberen Theil der Zelle etwa ⅔ seines Kupfergehalts verliert, während in der
Anodenabtheilung das ganze Ferro- in Ferrisulfat umgewandelt wird. Dieses letztere
wird continuirlich, wie es abflieſst, wieder dem Rinnenrührapparat unter Zufügung
des nöthigen Erzpulvers zugeführt und durchwandert den Apparat von Neuem.
Da es nothwendig ist, einen reinen Elektrolyten anzuwenden, so dürfte bei der Trennung
desselben von den ausgelaugten Erzen eine Centrifuge zweckmäſsige Dienste leisten.
Wenigstens steht zu erwarten, daſs durch Centrifugiren bessere Resultate im
Grossbetriebe eintreten werden als durch Filtriren.
In Betreff der Bestimmung des Kupfergehaltes manganhaltiger Geschicke mittels
Natriumsulfids wird auf die Aeuſserung von Dr. Stahl in
der Berg- und Hüttenmännischen Zeitung, 1889 S. 341
verwiesen.
Auf der Hamburger Gewerbeausstellung 1889 waren nach A.
Bock (Berg- und Hüttenmännische Zeitung, 1889
Nr. 26) das Kupferhüttenwerk von Ertel, Bieber und Co.
und die Norddeutsche Affinerie vertreten. Die Ausstellung der ersteren Firma, welche
lediglich Kiesabbrände verarbeitet, bestand aus rohem Kies (Pyrit), Kiesabbränden,
Kupferlauge und Cementkupfer, durch Eisen gefällt. Auch war Roheisen ausgestellt,
welches den ausgelaugten Kiesabbränden entstammte, jedoch nicht in Hamburg erzeugt
war. Die Norddeutsche Affinerie hatte eine prächtige Ausstellung ihrer Producte und
Rohmaterialien veranstaltet. Die Rohmaterialien der Elektrolyse waren Kupferregulus,
Rohkupfer in etwa 100k schweren Barren, gegossene
Anoden, Reste derselben und ein Glashafen, gefüllt mit silber- und goldhaltigem
Schlamm, der durch den Strom freigeworden war. Hierauf folgten die Kathoden als
chemisch reines Kupfer in verschiedenen Formen und den Zwecken angepaſst.
Rectanguläre Kathoden dienen in der Regel zur Blechfabrikation, deren Dimensionen 90,
70, 69cm Länge und resp. 73, 24 und 11cm Breite mit einer Durchschnittsdicke von 2cm betragen. Als Umschmelzmaterial werden 11cm breite Kathoden hergestellt, an deren
Längsseiten in regelmäſsigen Abständen correspondirende Einschnitte vorgesehen sind,
damit die Stücke leichter abgetrennt werden können, um sie in den Tiegel
einzusetzen.
Für die Drahtfabrikation ist die runde Form gewählt, deren Blöcke wahrscheinlich aus
ökonomischen Gründen auch meist gegossen werden, sie sind ca. 96cm lang mit 7cm
im Durchmesser; eine Collection Blech und Draht verschiedener Stärke von der Firma
Felten und Guillaume in Mühlheim a. d. R. gewalzt
und gezogen, lieferte den Beweis, dass der Zusammenhang der Atome auch des
Kathoden-Materials dem gegossenen Kupfer nichts nachgibt, und befanden sich darunter
2 Rollen solchen Drahtes von 0mm,4 Dicke, deren
89km,4 Länge 1k Kupfer entspricht. Ganz besonders interessant waren 2 Schaugläser mit
Kupferkrystallen von schön entwickelten und groſsen Exemplaren, sowie eine Kathode
mit unebener Oberfläche in Folge abnormer Krystallbildung.
Von anderen unedlen Metallen sahen wir noch chemisch reine Zinktafeln und Barren,
sowie Zinn; letztere beiden Metalle werden aber wohl dem Groſsbetrieb noch nicht
angehören und vorläufig nur wissenschaftlichen Werth haben. Das Zink ist
Nebenproduct von der Verarbeitung der Silbererze.
Auf die elektrolytische Abtheilung folgten die Producte des gewöhnlichen
Hüttenprozesses: Werkblei, Handelsblei, Antimonialblei in Barren, rothe
Handelsglätte in ganz feinen und gröberen Schuppen, antimonsaures Bleioxyd
(Abstrich) und Stückglätte.
Vitriole waren in denkbar reinsten Exemplaren von seltener Krystallgröſse und noch an
den Bleiruthen festsitzend, systematisch aufgehängt; es waren dies Nickel-, Kupfer-,
Eisen- und Salzburger Vitriol in je 2 und 4 Exemplaren, dann noch eine Composition
Einzelkrystalle hervorragender Gröſse. Wegen der allzuleichten Verwitterung muſsten
diese Vitriole öfter ausgewechselt werden.
Nebenproducte der Elektrolyse waren: ein Barren Rohgold, eine Gold-Kathode und ein
geschmolzener Goldbarren 1000/1000 fein. Die Kathoden hatten eine mehr höckerige
Oberfläche in Folge unregelmäſsiger kleiner Auswüchse, dagegen war das Gold im
geschmolzenen Zustande schön spiegelnd. Eine eigenthümliche Erscheinung zeigt jedoch
das hochfeine Gold noch, wenn es in Barren gegossen möglichst schnell gekühlt worden
ist, indem sich mehr oder weniger groſse Lamellen gebildet haben, deren Begrenzung
schwach trümmerartig zerrissen ist; dagegen bei gröſseren Barren, die einer
langsameren Erstarrung unterliegen., concentriren sich diese Lamellen in der
Längsbasis und bilden eine zerrissene tiefe Rinne, die sich nach den Enden
allmählich verliert.
An Präparaten gab es noch Platinschwamm, Platinsalmiak, Bleisuperoxyd,
Chlorpalladium, sämmtlich Nebenproducte der Goldelektrolyse.
Das Silber war in Barren verschiedener Grösse vertreten, theils aus der Elektrolyse,
theils auf gewöhnlichem Wege dargestellt, ebenso auch ein Schauglas mit
Kathodensilber, das bekanntlich wie Zinn nicht fest, sondern schuppig sich
abscheidet.
Die jährliche Durchsetzmenge an Rohmaterial, sowie die Gesammtproduction an
Handelswaare ist durch Würfelsysteme veranschaulicht worden.
Für das Rohschmelzen in Schachtöfen zeigte ein aus Glasscheiben zusammengestellter
Würfel an seinen Flächen je 12 Felder von gleichmäſsiger Länge, die je nach der
Quantität und dem Gewichte der einzelnen Beschickungsmaterialien ein mehr oder
weniger ungleichmäſsiges Volumen hatten. Durch sinnreiche Abwechselung der
Farbenauswahl war eine scharfe Begrenzung erreicht und somit sehr übersichtlich
gemacht worden. Dieser Würfel maſs etwa 11cm und
entsprach 1/120000
des jährlich zu verarbeitenden Quantums.
Das Gesammtgewicht der hieraus gewonnenen Edelmetalle ergib sich aus einem
Würfelsystem, das das Verhältniſs des der Scheidung unterworfenen Silbers und Goldes
veranschaulicht, und zwar ein 4½cm Silberwürfel
etwa 954g schwer und ein 1cm Goldwürfel 19g,26 schwer. Diese Gewichte mit 120000 multiplicirt, ergeben die jährliche Productionsmenge an
Edelmetall von etwa 11348k Silber und 2311k Gold.
Ein drittes System gehörte der Elektrolyse an und bestand aus einem 14cm messenden Kupferwürfel, etwa 24k schwer, einem 2cm Silberwürfel von etwa 83g,76 und
einem 5mm Goldwürfel, etwa 2g,432 schwer. Dieses System veranschaulicht das
Durchschnittsverhältniſs von Kupfer, Silber und Gold, wie diese Metalle durch
elektrochemische Behandlung des Rohkupfers gewonnen werden, und entspricht 1/70000 der
jährlichen Production, demnach dem Gesammtgewichte von etwa:
1701000k
Kupfer
5863k
Silber
170k
Gold
Dazu aus ge-wöhnl. Betrieb
–
„
11348k
„
2311k
„
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Tot.-Product.
1701000k
Kupfer
17211k
Silber
2481k
Gold
ausschlieſslich des Bleies, der Glätte und der Vitriole, für
deren Nachweis keine Zahlen vorliegen.
Unter Nr. 48029 ist dem Walther Feld und Dr. Georg v. Knorre in Charlottenburg ein Zusatzpatent
(gültig vom 23. Oktober 1888) zu Nr. 47201, betreffend ein Verfahren zur Darstellung
von Siliciumkupfer (D. p. J. 1889 272 445) ertheilt worden. Das für die Chlorabgabe benutzte Kupferchlorid
oder Kochsalz soll nunmehr durch äquivalente Mengen von Chlorkalium, Chlorcalcium
und Chlormagnesium oder durch Fluſsspath behufs Abgabe von freiem Fluor ersetzt
werden.
Zur Extraction von Gold aus Erzen wendet Hannay in Cove
Castle, Schottland (D. R. P. Nr. 49321 vom 13. April 1889) Apparate an, welche aus
einem Chlorirungsgefäſs, einer Anzahl Circulationspumpen, einer Filterpresse und
einer Chlorgaspumpe bestehen und mit den zugehörigen Verbindungsröhren, Hähnen und
Ventilen versehen sind.
Hierbei ist A das Chlorirungsgefäſs (Fig. 10), welches durch
das Mannloch A1 mit dem
gepulverten Erz beschickt wird, das – entweder auſserhalb oder innerhalb dieses
Gefäſses, – mit Wasser oder theilweise mit einer aus früheren Operationen erhaltenen
Flüssigkeit gemischt wird, bis dasselbe in einen durch eine Pumpe beförderbaren Brei
oder Schlamm gebracht ist. Das Gefäſs A steht durch ein
von dem Boden desselben abgehendes Rohr B und durch ein
von dem oberen Theile desselben abgehendes Rohr C mit
dem gemeinsamen Saugkasten d einer Anzahl
Circulationspumpen D in Verbindung, wobei jedes der
Rohre B bezieh. C mit
einem Absperrhahn oder Ventil b bezieh. c versehen ist. Auſserdem steht das Rohr B durch einen Hahn oder ein Ventil b1 mit der
Austrittsleitung aus den Pumpen D in Verbindung, welch
letztere Leitung durch eine einen Absperrhahn oder ein Absperrventil e besitzende Leitung E mit
einer Filterpresse F in Verbindung steht. Vermittelst
eines Rohres G kann das Chlorgas, welches auf irgend
eine der bekannten Weisen erzeugt oder aus einem Behälter mit flüssigem Chlor
entwickelt wird, entweder durch Oeffnen eines Hahnes oder Ventils g
direkt in das Gefäſs A nach Hindurchströmen eines in
den oberen Theil des letzteren ausmündenden, heberartig nach oben gebogenen
Rohrstückes G1 gelangen
oder durch Schlieſsen des Hahnes oder Ventils g das
nach unten heberartig gebogene Rohrstück G2 durchströmen und in den Ventilkasten H einer mit Wasser gefüllten Pumpe P einströmen. Diese Pumpe P arbeitet nach dem Prinzip der sogen. nassen Compressionspumpen, so daſs
der Plungerkolben derselben bei seiner Bewegung nach aufwärts und abwärts das in dem
Pumpencylinder und in dem mit dem letzteren in Verbindung stehenden, nach aufwärts
gebogenen Rohre P1
befindliche Wasser verschiebt, wobei das Chlorgas durch das Rohr G2 angesaugt und unter
einem gewissen Drucke durch das heberartige Rohr G1 in das Gefäſs A
eingepreſst wird. Diese Pumpe P kann auch als
Luftcompressionspumpe gebraucht werden, indem man die Zuleitung des Chlors durch
Absperren des Hahnes oder Ventils g1 unterbricht und durch Oeffnen des Hahnes oder
Ventils g2 die
atmosphärische Luft dem Saugkasten der Pumpe P
zuströmen läſst.
Der Betrieb des Apparates geschieht in folgender Weise:
Nachdem das Gefäſs A mit dem beinahe flüssigen
Erzschlamme beschickt und das Mannloch A1 dicht geschlossen worden ist, werden die
verschiedenen Hähne oder Ventile eingestellt, also cb1
g1 geöffnet und begg2 geschlossen und
die Pumpen D und P in
Bewegung gesetzt. Hierbei wird das Chlorgas in den Erzschlamm eingepreſst, welch
letzterer in steter Circulation von dem oberen Theile des Gefäſses A durch das Rohr C zu den
Pumpen D und von hier durch das Rohr B zu dem Boden des Gefäſses A erhalten wird. Ist das Metall durch das Chlorgas vollständig oder
beinahe vollständig gelöst, was durch Abziehen und Untersuchen einer Probe aus einer
der Röhren B oder C
constatirt werden kann, so wird die Stellung der Hähne oder Ventile entsprechend
verändert, also cb1
gg1 und g2 geschlossen bezieh.
geschlossen belassen und b und e geöffnet. Hierbei wird von der Pumpe D der
Erzschlamm aus dem Gefäſs A von dem Boden desselben aus
abgesaugt und in die Filterpresse F eingedrückt,
während, wenn der Hahn oder das Ventil g2 noch geöffnet und auch die Pumpe P noch in Bewegung gesetzt wird, Luft durch die Pumpe
P in den oberen Theil des Gefäſses A eingepreſst und dadurch das Entfernen des Inhalts des
Gefäſses A noch befördert werden kann.
Zuweilen erscheint es wünschenswerth, die Circulation des Schlammes auch noch
aufrecht zu erhalten, währenddem ein Theil dieses Schlammes in die Filterpresse
übergeführt wird. Um dieses zu ermöglichen, kann man einige Verbindungsrohre C1
C2 zwischen dem Rohr
C und dem Gefäſs A in
verschiedenen Niveauhöhen des letzteren anbringen, wobei diese Verbindungsrohre C1
C2 gleichfalls mit
Absperrhähnen oder -Ventilen zu versehen sind. Wird nur einer der letzteren geöffnet, während die
Hähne oder Ventile b1
und e nur theilweise geöffnet, b geschlossen und c geöffnet ist, so wird die
Circulation des Schlammes weiter vor sich gehen, während ein Theil des Inhalts des
Gefäſses A in die Filterpresse F übergeführt wird.
Die durch die Filterpresse F abgepreſste Flüssigkeit,
welche das Gold in Lösung enthält, wird dann in irgend einer bekannten Weise für die
Elimination des Goldes behandelt, wobei dann die erschöpfte Flüssigkeit (eventuell
auch die aus der Filterpresse ablaufende Flüssigkeit selber vor der weiteren
Behandlung derselben) ganz oder theilweie für die Herstellung des Erzschlammes für
die nachfolgende Operation benutzt wird (vgl. Hannay's
Verfahren D. p. J., 1888 269
368).
Die Cassel Gold Extracting Company in Glasgow schlägt vor (D. R. P. Nr. 47358 vom 21. December 1887), Gold und Silber aus Erzen, Lechen,
Schlacken u.s.w. in der Weise zu gewinnen, dass die pulverisirten gold- und
silberhaltigen Stoffe mit einer Lösung von Cyankalium, Cyannatrium etc. behandelt
werden, um das Edelmetall als Cyanid in Lösung zu bringen.
Die praktische Ausführung des Verfahrens wird in folgender Weise bewirkt:
Das Gold oder Silber enthaltende Erz etc, wird in Pulverform in einen Behälter
gebracht und mit der Lösung eines Cyanids gut untermischt. Der Behälter ist mit
einem Material bekleidet, welches durch die Cyanidlösung nicht wesentlich
angegriffen wird: zu diesem Zwecke eignen sich Behälter, die entweder aus Holz,
Eisen, Glas, Thonwaaren etc. gefertigt oder damit innen bekleidet sind. Das
Verfahren wird durch lebhaftes Umrühren der Mischung beschleunigt. Die Lösung läſst
man so lange auf das pulverisirte Erz etc. einwirken, bis das ganze oder nahezu
ganze Gold und Silber aufgelöst ist. Darauf wird die Lösung abgelassen und das Gold
und Silber aus der Cyanidlösung durch irgend eines der bekannten Verfahren gewonnen.
So gewinnt man z.B. das edle Gold und Silber aus der Cyanidlösung, indem man
dieselbe durch Zink in körniger Form seiht. Zu diesem Zwecke empfiehlt sich
besonders Zink in Form von Feilspänen oder feinen Schnitzeln. Nach Gewinnung der
Edelmetalle kann die Lösung zur Wiedergewinnung des Cyanalkalis weiter behandelt
werden.
Unter gewissen Umständen soll es sich empfehlen, die Einwirkung der Lösung auf das
pulverisirte Erz etc. unter Druck und bei höherer Temperatur vorzunehmen, in welchem
Falle ein geschlossener Behälter in Anwendung kommt.
Aehnliche Vorschläge wurden bereits von Reynier und
Thiollier gemacht (vgl. die nordamerikanischen (U. St. A.) Patente Nr.
246201 und 272391).
(Fortsetzung folgt.)
Tafeln